Crédit :Laboratoire national d'Oak Ridge
Alors que tous les virus ont des moyens de combattre le système immunitaire du corps, les scientifiques ont étudié comment le coronavirus SARS-CoV-2 - la cause de la pandémie mondiale de COVID-19 - peut échapper au système immunitaire chez l'homme.
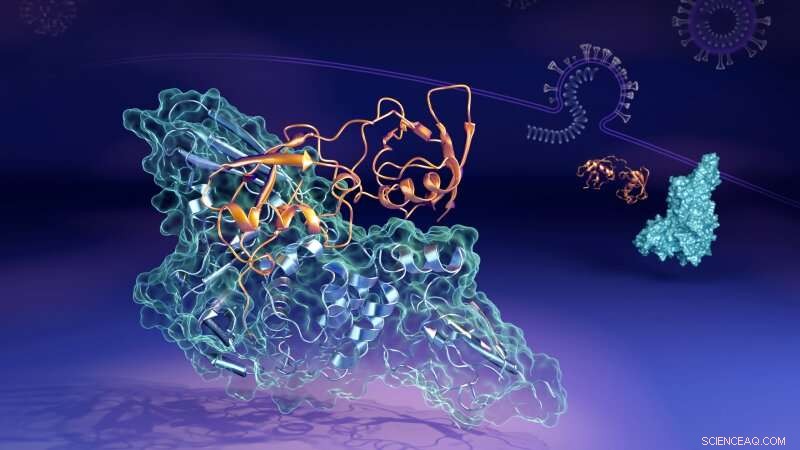
Aujourd'hui, des scientifiques travaillant au laboratoire national d'Oak Ridge (ORNL) du département américain de l'Énergie (DOE) ont révélé les détails moléculaires de la façon dont une protéine clé (la protéase de type papaïne, ou "PLpro") du virus se lie pour former une structure appariée, ou "complexe, " avec une protéine humaine nommée gène 15 stimulé par l'interféron (ISG15). PLpro supprime ISG15 d'autres protéines cellulaires humaines pour aider le SRAS-CoV-2 à échapper à la réponse immunitaire. Comprendre comment les deux protéines interagissent pourrait aider à développer des traitements médicamenteux thérapeutiques qui empêcher sa formation et permettre au système immunitaire d'une personne de mieux combattre le virus envahissant.
Les résultats de la recherche, intitulé "Dynamique conformationnelle dans l'interaction de la protéase de type papaïne SARS-CoV-2 avec la protéine du gène 15 stimulée par l'interféron humain, " ont été publiés dans le Journal des lettres de chimie physique .
« Dans les cellules humaines que le virus a infectées, le PLpro du virus SARS-CoV-2 a tendance à rechercher et à se lier à la protéine ISG15, un élément clé de la réponse immunitaire des cellules, " a déclaré Hugh O'Neill, chef du groupe Bio-Facilités de l'ORNL et directeur du Centre de biologie moléculaire structurale du laboratoire. "Lorsque PLpro se lie à ISG15, cela fait changer la forme de l'ISG15. La principale conclusion est que l'ISG15 peut prendre plusieurs formes lorsqu'il se lie à PLpro."
En utilisant la diffusion de neutrons aux petits angles (SANS) au réacteur à isotope à haut flux (HFIR) de l'ORNL, les chercheurs ont pu étudier les changements dans le complexe pendant qu'ils se produisaient.
"Nous avons amélioré le contraste entre le PLpro et l'ISG15 en préparant du PLpro dans lequel de nombreux atomes d'hydrogène ont été remplacés par des atomes de deutérium, " a déclaré Kevin Weiss, un expert en bio-deutération. "Les neutrons interagissent différemment avec les atomes de deutérium, cela nous a donc aidé à mieux différencier les deux protéines.
"Nous avons utilisé des neutrons pour analyser le complexe en solution, qui simule mieux l'environnement physiologique réel du corps humain, " dit Leighton Coates, responsable de la science et de la technologie des systèmes d'instruments pour la deuxième station cible de l'ORNL. « Cela nous a permis d'étudier les formes changeantes du complexe, que d'autres techniques n'auraient pas pu reprendre."
"Les informations que nous avons obtenues de nos expériences augmentent notre connaissance du fonctionnement du virus et nous permettront de construire des modèles informatiques plus précis pour d'autres scientifiques à utiliser, " dit Wellington Leite, auteur principal et chercheur postdoctoral de l'ORNL. "Les chercheurs pourront utiliser le modèle pour rechercher rapidement des sites sur l'ISG15 où le PLpro se connecte, puis essayer de bloquer ces sites."
Susan Tsutakawa, un scientifique du personnel biochimiste au Lawrence Berkeley National Laboratory (Berkeley Lab), obtenu des données de diffusion des rayons X aux petits angles (SAXS) sur le complexe PLpro-ISG15 du synchrotron à source lumineuse avancée du Berkeley Lab. "Dans les études SAXS, nous pourrions séparer différents complexes dans l'échantillon en couplant SAXS avec la chromatographie d'exclusion stérique et en même temps, obtenir des données à plus haute résolution de la configuration globale du complexe, pour compléter les études SANS qui ont révélé les conformations des composants individuels du complexe, " dit Tsutakawa.
L'équipe prévoit de mener des expériences supplémentaires sur ce type de complexe biologique pour examiner comment de petites molécules peuvent bloquer la liaison de PLpro à ISG15.