Crédit :Université des sciences et technologies de Pohang (POSTECH)
Les moules survivent en adhérant aux rochers dans les vagues féroces ou les marées sous-marines. Les matériaux imitant cette adhérence sous-marine sont largement utilisés pour l'adhérence de la peau ou des os, pour modifier la surface d'un échafaudage, ou même dans des systèmes d'administration de médicaments ou de cellules. Cependant, ces matériaux n'ont pas entièrement imité les capacités des moules.
Une équipe de recherche conjointe de POSTECH et de l'Université nationale de Kangwon (KNU) - dirigée par le professeur Hyung Joon Cha et Ph.D. le candidat Mincheol Shin du département de génie chimique de POSTECH avec le professeur Young Mee Jeong et le Dr Yeonju Park du département de chimie de KNU—a analysé la Dopa et la lysine, qui sont les acides aminés qui composent les protéines adhésives de surface sécrétées par les moules, et vérifié que leurs rôles sont liés à leur emplacement. L'équipe a fait un pas de plus pour révéler le secret de l'adhésion sous-marine en découvrant que ces acides aminés peuvent contribuer à l'adhésion et à la cohésion de surface différemment selon leur emplacement spécifique.
La caractéristique des protéines adhésives des moules qui ont été imitées jusqu'à présent est qu'elles contiennent un grand nombre d'un acide aminé unique appelé Dopa. Dopa est un acide aminé modifié avec un autre groupe hydroxyle attaché à la tyrosine, et la recherche sur l'adhérence sous-marine a commencé avec le fait que Dopa constitue un composant important de la protéine adhésive.
Cependant, l'équipe de recherche s'est interrogée sur le fait que cette excellente adhérence sous-marine des moules est permise par une seule molécule et s'est concentrée sur l'observation du nombre et de la localisation de la lysine, qui est un acide aminé aussi fréquent que Dopa.
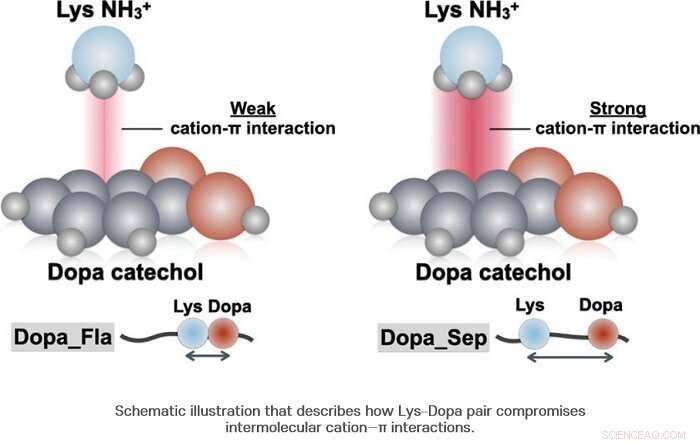
Par conséquent, l'équipe de recherche a découvert que la Dopa et la lysine sont liées l'une à l'autre avec environ la moitié de la probabilité. D'autre part, il a été révélé que contrairement à ce qui a été connu jusqu'à présent, lorsque la Dopa et la lysine sont attachées ensemble, ils ne produisent pas toujours une synergie positive. Les chercheurs ont confirmé que dans le cas de l'interaction cation-π, une synergie négative est plutôt produite.
Quand Dopa et Lysine sont ensemble, une différence dans la densité des molécules d'eau se produit au niveau microscopique et la concentration des molécules d'eau autour de Dopa est abaissée. Cette concentration abaissée permet une différence dans la force de liaison hydrogène entre le cycle benzénique et le groupe hydroxyle de Dopa, abaissant ainsi la stabilité structurelle du complexe cation-π. En utilisant la spectroscopie Raman, l'équipe de recherche a confirmé que le CH
Les résultats de cette étude permettent de confirmer comment la protéine adhésive des moules a été conçue, et il semble prometteur d'être applicable à la recherche sur les protéines adhésives d'autres organismes à l'avenir.
"Avec cette nouvelle découverte sur la synergie entre Dopa et lysine, qui sont connus pour jouer toujours un rôle positif dans l'adhérence sous l'eau, il changera le cadre de la conception des matériaux adhésifs, " a fait remarquer le professeur Hyung Joon Cha qui a dirigé les recherches.
Cette recherche, qui a été récemment publié dans Chimie des Matériaux , a été menée dans le cadre de l'étude intitulée « Comprendre le mécanisme d'adhésion sous-marine des organismes adhésifs :contrôler l'équilibre entre l'adhésion de surface et la cohésion, " qui est un programme de recherche à mi-carrière du ministère des Sciences et des TIC et de la Fondation nationale pour la recherche de Corée.