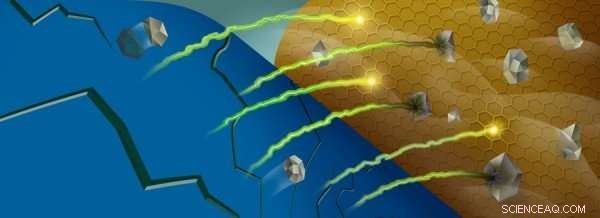
Lorsque les ions manganèse (gris) sont extraits de la cathode d'une batterie (bleu), ils peuvent réagir avec l'électrolyte de la batterie près de l'anode (or), piégeant les ions lithium (vert/jaune). Crédit :Robert Horn/Laboratoire national d'Argonne
Comme toi, moi et tous ceux que nous connaissons, les batteries ont une durée de vie limitée.
Lorsqu'une batterie entre dans la « vieillesse, " les scientifiques qualifient ses performances réduites de " décoloration de la capacité, " dans laquelle la quantité de charge qu'une batterie peut fournir diminue avec une utilisation répétée. La perte de capacité est la raison pour laquelle une batterie de téléphone portable qui durait toute une journée le fera, après quelques années, ne durent peut-être que quelques heures.
Mais et si les scientifiques pouvaient réduire cette capacité s'estomper, permettre aux batteries de vieillir plus gracieusement ?
« Maintenant que nous connaissons les mécanismes du piégeage des ions lithium et que la capacité s'estompe, nous pouvons trouver des méthodes pour résoudre le problème."
Des chercheurs du laboratoire national d'Argonne du département américain de l'Énergie (DOE) ont identifié l'un des principaux responsables de l'affaiblissement de la capacité des batteries lithium-ion à haute énergie dans un article publié dans The Journal of the Electrochemical Society.
Pour une batterie lithium-ion - le genre que nous utilisons dans les ordinateurs portables, smartphone, et les véhicules électriques hybrides rechargeables - la capacité de la batterie est directement liée à la quantité d'ions lithium qui peut être transportée dans les deux sens entre les deux bornes de la batterie lorsqu'elle est chargée et déchargée.
Cette navette est permise par certains ions de métaux de transition, qui changent d'état d'oxydation lorsque les ions lithium entrent et sortent de la cathode. Cependant, comme la batterie est cyclée, certains de ces ions, notamment le manganèse, sont extraits du matériau de la cathode et se retrouvent à l'anode de la batterie.
Une fois près de l'anode, ces ions métalliques interagissent avec une région de la batterie appelée interphase solide-électrolyte, qui se forme à cause des réactions entre l'anode hautement réactive et l'électrolyte liquide qui transporte les ions lithium dans les deux sens. Pour chaque molécule d'électrolyte qui réagit et se décompose dans un processus appelé réduction, un ion lithium se retrouve piégé dans l'interphase. Comme de plus en plus de lithium est piégé, la capacité de la batterie diminue.
Certaines molécules de cette interphase sont incomplètement réduites, ce qui signifie qu'ils peuvent accepter plus d'électrons et attacher encore plus d'ions lithium. Ces molécules sont comme de l'amadou, en attendant une étincelle.
Lorsque les ions manganèse se déposent dans cette interphase, ils agissent comme une étincelle enflammant l'amadou :ces ions sont efficaces pour catalyser des réactions avec les molécules incomplètement réduites, piégeant plus d'ions lithium dans le processus.
"Il y a une corrélation stricte entre la quantité de manganèse qui se dirige vers l'anode et la quantité de lithium qui est piégée, " a déclaré Daniel Abraham, co-auteur de l'étude et scientifique de l'Argonne. " Maintenant que nous connaissons les mécanismes derrière le piégeage des ions lithium et la décoloration de la capacité, nous pouvons trouver des méthodes pour résoudre le problème."