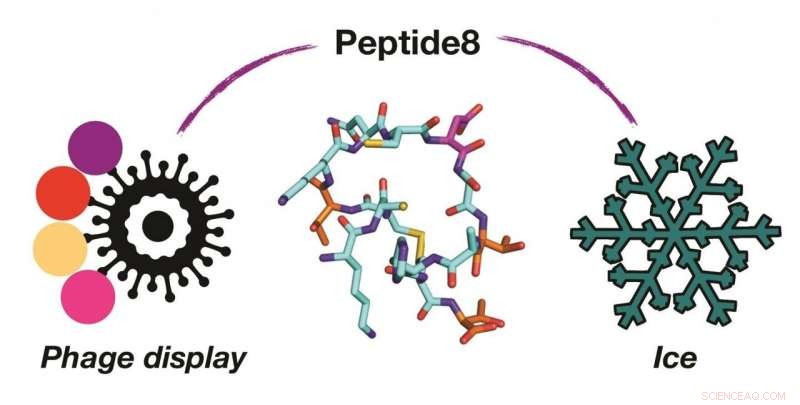
Utilisation de virus (phage display) pour identifier la molécule sur un milliard (peptide8) qui contrôle la formation de glace. Crédit :Université de Warwick
Contrôler, et atténuer les effets de la croissance de la glace est crucial pour protéger les infrastructures, aide à préserver les cellules congelées et à améliorer la texture des aliments congelés. Une collaboration internationale de scientifiques de Warwick travaillant avec des chercheurs suisses a utilisé une plate-forme d'exposition sur phage pour découvrir de nouvelles, petit, peptides qui fonctionnent comme des protéines antigel plus grosses. Cela présente un itinéraire vers de nouveaux, plus facile à synthétiser, cryoprotecteurs. Légende :Utilisation de virus (phage display) pour identifier la molécule sur un milliard (peptide8) qui contrôle la formation de glace.
Protéines liant la glace, qui comprend des protéines antigel, sont produites par une large gamme d'espèces à partir de poissons, aux insectes aux plantes, pour éviter les dommages causés par la glace. Les protéines remplissent la fonction remarquable de reconnaître et de se lier à la glace, même dans l'énorme excès d'eau (dont la glace est la forme solide). De nouvelles protéines antigel ont généralement été découvertes par isolement à partir des organismes.
Dans ce travail, l'équipe a adopté une approche très différente en criblant des milliards de peptides possibles pour trouver ceux qui pourraient se lier à la glace. Ceci a été réalisé par Phage Display, une technologie par laquelle un virus est utilisé pour générer un grand nombre de peptides, et ceux qui « se lient » à la glace peuvent être isolés.
En utilisant cela, un peptide cyclique de seulement 14 acides aminés (ce qui est très court par rapport à une protéine typique) a été découvert qui pourrait se lier à la glace. L'équipe a utilisé des simulations informatiques pour comprendre comment le peptide se lie à la glace, ce qui n'est pas possible par les seules techniques expérimentales « humides ». L'équipe a également montré comment ce peptide court peut être utilisé pour aider à purifier d'autres protéines par purification par affinité ace.
En identifiant ces peptides courts, cela signifie que les chercheurs peuvent désormais simplement fabriquer (ou acheter) des peptides modifiés pour comprendre et sonder comment ceux-ci interagissent avec la glace et aider à concevoir de nouveaux cryoprotecteurs avec des structures simplifiées, et donc à moindre coût.
Dans l'article "A Minimalistic Cyclic Ice-Binding Peptide from Phage Display", Publié dans Communication Nature l'équipe internationale comprenant l'Université de Warwick et dirigée par l'EPFL, La Suisse, ont démontré l'utilisation du phage display pour découvrir de nouveaux peptides antigel minimalistes, ce qui ne pourrait pas être réalisé par des outils conventionnels, qui ne permettrait pas de passer au crible les milliards de structures potentielles.
Dr Gabriele Sosso, Professeur assistant à l'Université de Warwick, au département de chimie commente :« Ce travail met en évidence que même de très petits changements au sein de la structure de ces peptides peuvent faire une énorme différence dans leur capacité à contrôler la formation de glace. Nos simulations informatiques nous ont permis d'identifier et de comprendre l'importance de ces changements structurels, ce qui est une étape clé vers la conception rationnelle de cryoprotecteurs synthétiques.
"C'est un tel privilège de pouvoir tirer parti à la fois du travail expérimental du groupe Gibson et des ressources de calcul du SCRTP. Vraiment, Warwick est un endroit formidable si vous voulez comprendre comment la glace se forme et que pouvons-nous faire pour avoir notre mot à dire dans ce processus."
Professeur Matthew Gibson, Le professeur de l'Université de Warwick au département de chimie et à la faculté de médecine de Warwick ajoute :« Nous avons travaillé sur le développement d'outils synthétiques pour comprendre, et interférer avec, processus de croissance de la glace dans le but de contribuer au développement de nouveaux cryoprotecteurs. Ce travail était vraiment passionnant, comme nous avons utilisé des outils de biotechnologie (phage) pour découvrir de petits, cyclique, des peptides remarquablement puissants.
« Ces peptides sont faciles à synthétiser et à modifier et accéléreront nos recherches dans ce domaine. combinant des études expérimentales et de calcul ensemble. Nous sommes également reconnaissants pour le soutien de l'IAS à Warwick, qui a permis au Dr Stevens de nous rendre visite pour compléter ce travail, montrant la nécessité de soutenir les collaborations scientifiques internationales.