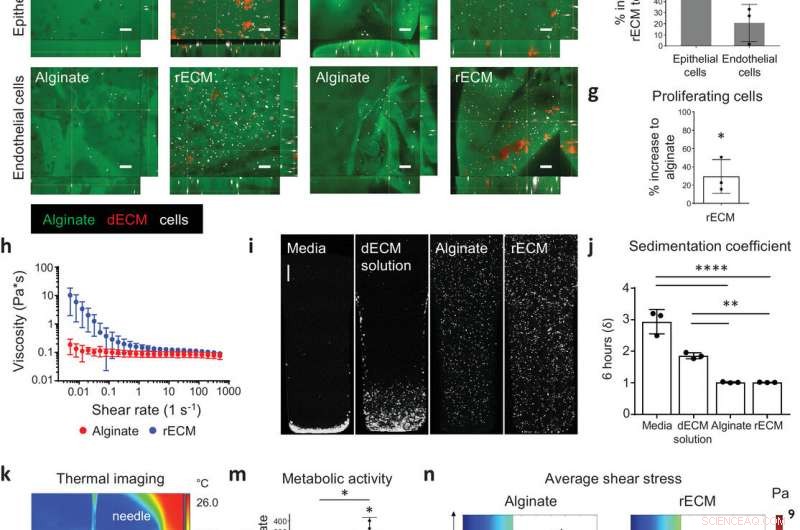
Caractérisation des hydrogels hybrides rECM. a) Image d'hydrogels d'alginate et de rECM de souris. Barres d'échelle :1 mm. b) Hydrogel rECM modifié alginate-fluorescéine et ECM-rhodamine montrant la distribution des composants alginate et ECM dans l'hydrogel (voir également la vidéo S1 dans les informations complémentaires). Barre d'échelle :200 µm. c) Image SEM d'hydrogels. Barres d'échelle :50 µm. d) Strain crossover (%) entre le module de stockage et de perte dans les hydrogels d'alginate (2%) et les hydrogels rECM (2% d'alginate, 5 mg mL−1 ECM) (n = 3 par groupe). e) Images d'immunofluorescence d'épithéliales pulmonaires murines MLE12 et endothéliales bEnd3 (cellules en blanc) dans alginate-fluorescéine (vert) et solution ECM-hydrogels rECM modifiés à la rhodamine (rouge) au jour 0 (jour de l'ensemencement) et au jour 7. Barres d'échelle :100 µm f) Augmentation en pourcentage de l'activité métabolique des cellules épithéliales (MLE12) et des cellules endothéliales (bEnd.3) dans les hydrogels rECM par rapport aux hydrogels d'alginate au jour 7 (n = 3 par groupe). g) Augmentation en pourcentage des cellules épithéliales murines proliférantes EdU+ (MLE12) dans les hydrogels de rECM par rapport aux hydrogels d'alginate au jour 5 (n = 3 par groupe). h) Rhéométrie oscillatoire (n = 3 par groupe). i) Images confocales de sédimentation cellulaire et j) coefficient de sédimentation calculé (δ) des cellules A549 dans des milieux de culture cellulaire DMEM-F12, alginate, solution dECM et rECM dérivée de souris pendant 6 h (n = 3 par groupe). Barre d'échelle :500 µm. k) Thermographie de l'impression FRESH (voir la vidéo S2 dans les informations complémentaires). l) Tube creux rECM bio-imprimé en 3D et structure de ramification (voir les vidéos S3 et S4 dans les informations complémentaires). Barres d'échelle :2 mm. m) Activité métabolique (test WST‐1) au jour 7 de cellules A549 ensemencées (in vitro) et imprimées en 3D dans des hydrogels (n = 3 par groupe). n) Profils moyens de contrainte de cisaillement des bioencres. Crédit: Matériaux avancés (2020). DOI :10.1002/adma.202005476
Des chercheurs de l'Université de Lund ont conçu une nouvelle bioencre qui permet pour la première fois de bio-imprimer en 3D de petites voies respiratoires à taille humaine à l'aide de cellules de patients. Les constructions imprimées en 3D sont biocompatibles et soutiennent la croissance de nouveaux vaisseaux sanguins dans le matériau transplanté. Il s'agit d'un premier pas important vers l'impression 3D d'organes. La nouvelle étude a été publiée dans Matériaux avancés .
Les maladies pulmonaires chroniques sont la troisième cause de décès dans le monde avec un coût pour l'UE de plus de 380 milliards d'euros par an. Pour de nombreuses maladies chroniques, il n'y a pas de remède et la seule option en phase terminale pour les patients est la transplantation pulmonaire. Cependant, il n'y a pas assez de poumons de donneurs pour répondre à la demande clinique.
Par conséquent, les chercheurs cherchent des moyens d'augmenter la quantité de poumons disponibles pour la transplantation. Une approche consiste à fabriquer des poumons en laboratoire en combinant des cellules avec un échafaudage bio-ingénierie.
"Nous avons commencé petit en fabriquant de petits tubes, car il s'agit d'une caractéristique trouvée à la fois dans les voies respiratoires et dans le système vasculaire du poumon. En utilisant notre nouvelle bioencre avec des cellules souches isolées des voies respiratoires des patients, nous avons pu bioimprimer de petites voies respiratoires qui avaient plusieurs couches de cellules et restaient ouvertes au fil du temps, " explique Darcy Wagner, professeur agrégé et auteur principal de l'étude.
Les chercheurs ont d'abord conçu une nouvelle bioencre (un matériau imprimable avec des cellules) pour la bioimpression 3D de tissus humains. La bioencre a été réalisée en combinant deux matériaux :un matériau dérivé d'algues, alginate, et la matrice extracellulaire dérivée du tissu pulmonaire.
Cette nouvelle bioencre accompagne le matériau bio-imprimé à plusieurs étapes de son évolution vers le tissu. Ils ont ensuite utilisé la bioencre pour imprimer en 3D de petites voies respiratoires humaines contenant deux types de cellules trouvées dans les voies respiratoires humaines. Cependant, cette bioencre peut être adaptée à tout type de tissu ou d'organe.
"Ces bio-encres de nouvelle génération soutiennent également la maturation des cellules souches des voies respiratoires en plusieurs types de cellules trouvées dans les voies respiratoires humaines adultes, ce qui signifie que moins de types de cellules doivent être imprimés, simplifier le nombre de buses nécessaires pour imprimer des tissus constitués de plusieurs types de cellules, " dit Darcy Wagner.
Wagner note que la résolution doit être améliorée pour imprimer en 3D des tissus pulmonaires plus distaux et les sacs d'air, connu sous le nom d'alvéoles, qui sont vitaux pour les échanges gazeux.
« Nous espérons que de nouvelles améliorations technologiques des imprimantes 3D disponibles et de nouvelles avancées en matière de bioencre permettront une bioimpression à une résolution plus élevée afin de concevoir des tissus plus grands qui pourraient être utilisés pour la transplantation à l'avenir. Nous avons encore un long chemin à parcourir, " elle dit.
L'équipe a utilisé un modèle murin ressemblant étroitement à l'immunosuppression utilisée chez les patients subissant une transplantation d'organe. Une fois transplanté, ils ont découvert que les constructions imprimées en 3D à partir de la nouvelle bioencre étaient bien tolérées et soutenaient de nouveaux vaisseaux sanguins.
« Le développement de cette nouvelle bioencre est une avancée significative, mais il est important de valider davantage la fonctionnalité des petites voies aériennes au fil du temps et d'explorer la faisabilité de cette approche dans de grands modèles animaux, " conclut Martina De Santis, le premier auteur de l'étude.