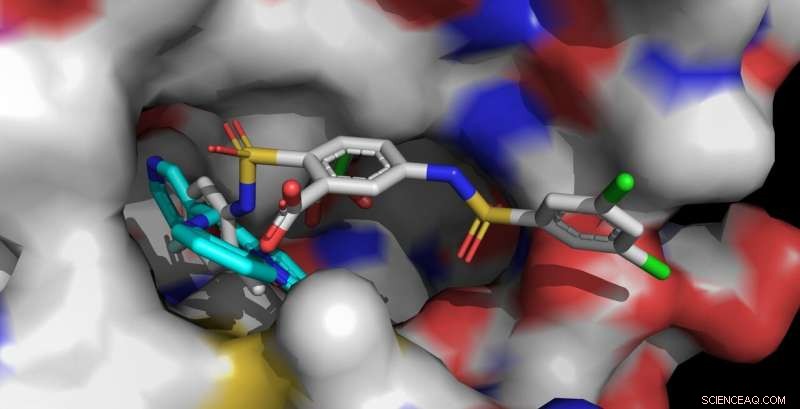
Les activateurs Sirt6 UBCS039 (cyan, avant gauche) et MDL-801 (multicolore, avant droit) sont ancrés dans la même poche de reliure de Sirt6. La molécule MDL-801 plus longue entre également en contact avec des surfaces adjacentes et interagit plus fortement avec Sirt6. Crédit :Clemens Steegborn
Dans la recherche de moyens de lutter efficacement contre les maladies humaines liées à l'âge, l'enzyme sirtuine 6 (Sirt6) est récemment devenue un objet de recherche biochimique. Une activation ciblée de Sirt6 pourrait prévenir ou atténuer de telles maladies, par exemple certains types de cancer. Dans un article pour le journal Nature Chimie Biologie , des biochimistes de l'Université de Bayreuth ont maintenant montré comment la petite molécule MDL-801 se lie à l'enzyme Sirt6 et influence son activité. Ces découvertes devraient aider au développement de nouveaux médicaments.
Le corps humain contient sept sirtuines différentes, nommé Sirt1 à Sirt7. Ces enzymes jouent un rôle essentiel dans la régulation du métabolisme et des réactions de stress. Dans les années récentes, l'équipe de recherche dirigée par le professeur Dr. Clemens Steegborn à l'Université de Bayreuth a montré dans plusieurs articles de recherche comment Sirt6 peut être activé par de petites molécules. Avec leur étude, maintenant publié dans Nature Chimie Biologie , Steegborn et son assistant de recherche, le Dr Weijie You, ont suivi ces découvertes. Ils ont découvert que la molécule MDL-801 interagit avec Sirt6 en utilisant une caractéristique structurelle unique de cette enzyme :une poche de liaison inhabituellement large qui est facilement accessible de l'extérieur et est normalement impliquée dans l'interaction avec les protéines substrats. Cette cavité moléculaire se poursuit dans un canal ouvert qui mène au centre catalytique de Sirt6. C'est dans cette chaîne, caractéristique de Sirt6, que le MDL-801 s'ancre lorsqu'il active l'enzyme. Principalement par des études d'activité et des analyses de structure aux rayons X, Steegborn et You ont pu identifier à la fois le site de liaison et les processus moléculaires impliqués dans l'activation de Sirt6 par MDL-801.
Comme les biochimistes de Bayreuth l'ont déjà montré dans des études antérieures, les substances actives UBCS039, quercétine, et la fluvastatine sont également capables d'activer Sirt6. Faire cela, ils utilisent le même canal ouvert dans lequel le MDL-801 s'amarre. Cette cavité allongée est également appelée canal acyle. Dès que Sirt6 est dans un état activé, il sépare les groupes acyle des protéines. Ainsi, cela influence, entre autres, la synthèse de protéines contrôlées par des gènes. Les découvertes sur l'activation de Sirt6 offrent donc des indices précieux pour le développement de substances actives qui pourraient contrecarrer les maladies liées au vieillissement, par exemple le développement de tumeurs.
« Toutes les petites molécules pour lesquelles nous avons pu jusqu'à présent démontrer un effet activateur sur Sirt6 utilisent le canal acyle pour se lier à la Sirtuine 6. Et bien que leurs structures chimiques soient très différentes, ils le font de manière très similaire. Cela nous ouvre la possibilité d'utiliser les détails de leurs interactions respectives pour affiner les composés activateurs. De tels médicaments seraient alors capables de réguler Sirt6 d'une manière spécifique. Ainsi, ils pourraient être utilisés de manière ciblée pour prévenir ou guérir les maladies associées au processus de vieillissement, " dit Steegborn.
Avec leur nouvelle étude, Steegborn et You ont réfuté une déclaration clé qu'un groupe de recherche de Shanghai a publiée dans Nature Chimie Biologie en 2018. Dans cet article, Le MDL-801 a été décrit comme un nouvel activateur de Sirt6. Une structure cristallographique aux rayons X a été utilisée pour montrer que le MDL-801 se lie à une section moléculaire différente de Sirt6 par rapport aux autres activateurs. « Cette structure, résultant d'une mauvaise interprétation des données expérimentales, a induit en erreur de nombreuses équipes de recherche depuis sa publication. Notre étude corrige cette erreur et permet ainsi de travailler efficacement sur des activateurs améliorés, " dit Steegborn.