Crédit :Wiley
Certains médicaments utiles consistent en des peptides agissant sur leurs cibles protéiques. Pour les rendre plus efficaces et stables, les scientifiques ont trouvé un moyen de remplacer des segments cruciaux des peptides par des unités uréido. Ces oligourées, qui sont composés d'unités à base d'urée, se replier dans une structure similaire à celle des peptides. Les "faux" peptides à base d'oligourée améliorent les options de conception rationnelle de médicaments, conclut l'étude publiée dans la revue Angewandte Chemie .
Plusieurs médicaments sont des peptides qui inhibent ou activent les actions de certaines protéines. Pour augmenter leur efficacité, les scientifiques étudient les imitateurs de peptides. Les imitateurs de peptides contiennent des brins de petites unités organiques qui ressemblent aux acides aminés - les éléments constitutifs des peptides - mais ne leur sont pas identiques. La raison en est que les enzymes protéolytiques attaqueront moins probablement ces faux brins peptidiques, donc les médicaments seraient plus efficaces.
Cependant, les brins synthétiques, appelés oligomères, doivent se replier dans la structure du peptide d'origine pour se lier correctement à sa protéine cible. Gilles Guichard et son équipe du CNRS, Université de Bordeaux, et collègues de l'Université de Strasbourg et d'Ureka Pharma, Mulhouse, La France, ont exploré des oligomères constitués d'unités uréido, qui sont des dérivés de l'urée. Ces oligourées se replient en hélice, l'une des structures caractéristiques des peptides. Cependant, il y a de légères différences. "Les hélices Oligourea ont moins de résidus par tour, une plus petite montée par tour, et un diamètre plus grand que l'hélice alpha du peptide d'origine, " dit Guichard.
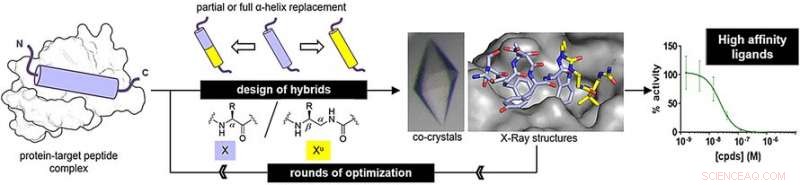
Pour déterminer si les oligourées pouvaient imiter de vraies structures peptidiques, les chercheurs ont préparé des hybrides peptide-oligourée et étudié leur liaison aux protéines cibles. L'une des cibles, MDM2, est un régulateur naturel de la protéine suppresseur de tumeur p53. L'autre, VDR, est une protéine nécessaire à la régulation de la croissance cellulaire, immunité, et d'autres fonctions biologiques.
Pour le mimétique peptidique de liaison à MDM2, les chercheurs ont préparé des hybrides en remplaçant trois acides aminés clés terminaux par des unités uréido. Pour l'imitateur de peptide de liaison VDR, ils ont remplacé le segment d'acide aminé moyen par des unités uréido. Après quelques rondes d'optimisation, les auteurs ont trouvé des structures hybrides avec des affinités de liaison élevées.
Les affinités de liaison étaient similaires à celles des peptides originaux. De plus, L'analyse aux rayons X a révélé que les structures hybrides adoptaient une structure hélicoïdale régulière. Cependant, les hélices étaient encore un peu plus larges et avaient des espaces plus grands entre les chaînes latérales le long du squelette oligourée que ceux des peptides naturels.
Les hybrides peptide-oligourée devraient résister à la dégradation protéolytique, un objectif important en chimie médicinale. Un autre avantage est qu'ils permettent plus de modifications. "Les acides aminés alpha peuvent être substitués à deux positions, mais les unités ureido ont un site de plus, ", explique Guichard. Cela signifie que les médicaments hybrides peptide-oligourée offrent plus d'options d'optimisation.