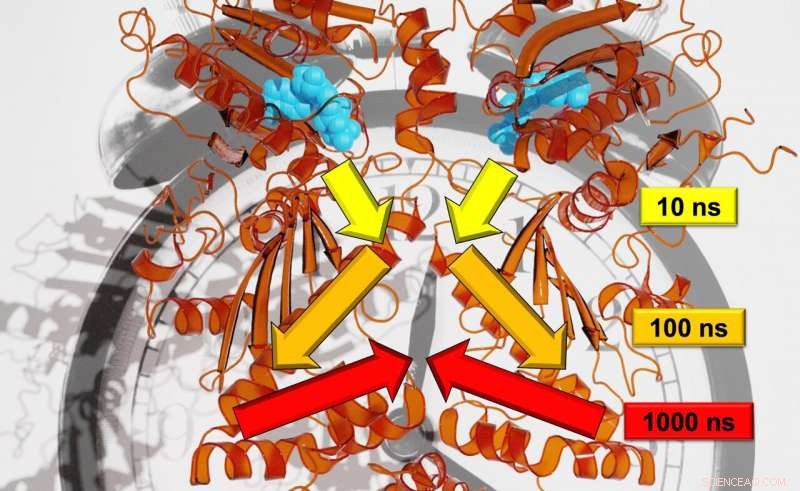
Des chercheurs de Fribourg ont pu analyser le taux précis de transfert de signal sur plusieurs échelles de temps. Crédit :Steffen Wolf
Considérez un instant un arbre se balançant dans le vent. Combien de temps faut-il au mouvement d'une brindille pour atteindre le tronc de l'arbre ? Comment ce mouvement est-il réellement transmis à travers l'arbre ? Des chercheurs de l'Université de Fribourg transfèrent ce genre de question à l'analyse des protéines, qui sont la machinerie moléculaire des cellules.
Une équipe de chercheurs dirigée par le Prof. Dr. Thorsten Hugel de l'Institut de Chimie Physique, et le Dr Steffen Wolf et le professeur Gerhard Stock de l'Institut de physique étudient comment les signaux qui provoquent des changements structurels dans les protéines se déplacent d'un site à un autre. Ils essaient également de déterminer à quelle vitesse ces mécanismes interviennent. Jusqu'à maintenant, les chercheurs ont été incapables d'analyser le taux précis de transfert de signal, car il implique de nombreuses échelles de temps, allant de la nanoseconde à la seconde. Les chercheurs de Fribourg, cependant, ont maintenant atteint une telle résolution en combinant diverses expériences, simulation, et études théoriques. Ils publient leurs résultats dans la revue scientifique Sciences chimiques .
Contrairement aux arbres, les mouvements de la protéine analysés dans l'étude, Hsp90, se dérouler sur des échelles de temps logarithmiques. Chaque grand mouvement prend environ dix fois plus de temps que le petit, mouvements individuels qui composent le plus grand. Loup explique, "Par exemple, une brindille se déplace sur une échelle de temps de secondes; la branche avec dix secondes; et le tronc avec 100 secondes. » En utilisant une combinaison de méthodes expérimentales et théoriques de pointe, les chercheurs ont pu surveiller la communication allostérique, en d'autres termes, pour montrer comment un processus de réaction dans Hsp90 a modifié un site de liaison à une protéine distante. Selon Stock, l'équipe a découvert la hiérarchie des dynamiques sur laquelle se déroule ce processus allostérique, qui incluent les échelles de temps de la nanoseconde à la milliseconde et les échelles de longueur allant du picomètre à plusieurs nanomètres.
De plus, le processus de réaction dans Hsp90 est couplé à un changement structurel dans le seul acide aminé Arg380. Arg380 transmet ensuite des informations structurelles à un sous-domaine de la protéine, et ultimement, le transmet à la protéine dans son ensemble. Le changement de structure qui en résulte ferme un site de liaison central de la protéine, lui permettant ainsi de remplir de nouvelles fonctions. Les chercheurs de l'Université de Fribourg soupçonnent que des mécanismes hiérarchiques similaires tels que celui démontré dans la protéine Hsp90 sont également d'une importance fondamentale dans le transfert de signaux au sein d'autres protéines. Hugel dit que cela pourrait être utile pour utiliser des médicaments pour contrôler les protéines.