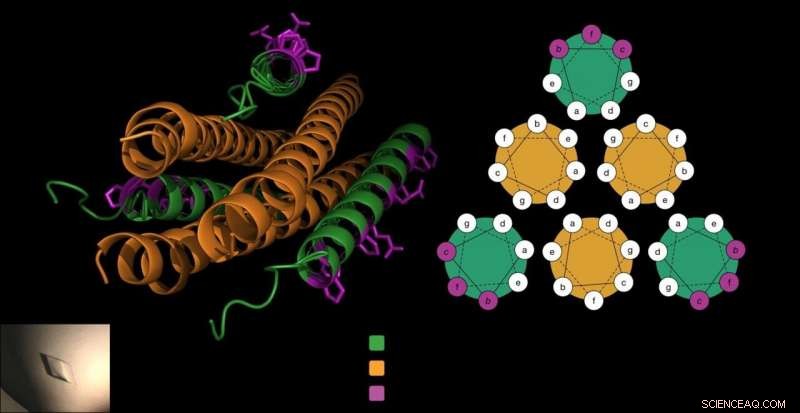
Le peptide anti-viral est composé de trois tire-bouchons (en vert), qui se verrouillent autour de la protéine de fusion du virus (en orange) pour empêcher le virus de pénétrer dans les cellules. Le laboratoire Gellman a ajouté des acides aminés bêta uniques au peptide (en violet) d'une manière qui n'interfère pas avec cette interaction cruciale et rend le peptide plus stable. Crédit :Victor Hors-la-loi.
En créant un petit morceau de protéine, ou peptidique, qui peuvent empêcher la fixation des virus parainfluenza humains aux cellules, des chercheurs ont amélioré une méthode dans des modèles de rongeurs destinée à aider à garder les enfants en bonne santé.
Virus parainfluenza humains, ou HPIV, sont la principale cause d'infections respiratoires infantiles, responsable de 30 à 40 % des maladies comme le croup et la pneumonie. Les virus affectent également les personnes âgées et les personnes dont le système immunitaire est affaibli.
Pour rendre les gens malades, Les HPIV doivent s'accrocher aux cellules et injecter leur matériel génétique pour commencer à fabriquer de nouveaux virus. HPIV3 est le plus répandu parmi ces virus. Il n'existe actuellement aucun vaccin ou antiviral approuvé pour l'infection à HPIV3 chez l'homme.
Dans une étude menée par le laboratoire Sam Gellman du département de chimie de l'Université du Wisconsin-Madison, et le laboratoire d'Anne Moscona et Matteo Porotto à Columbia University, les chercheurs se sont appuyés sur des années de travail sur les traitements peptidiques pour en générer un capable de bloquer le processus d'attachement de HPIV3.
Les chercheurs ont publié leurs résultats le 7 avril dans le Journal de l'American Chemical Society .
Pour entrer dans les cellules hôtes, Les HPIV utilisent des protéines de fusion spécialisées qui ressemblent à trois tire-bouchons posés côte à côte. Des travaux antérieurs du laboratoire Moscona-Porotto ont montré que les scientifiques pouvaient une partie partielle de cette protéine tire-bouchon de HPIV3, introduire ce peptide dans le virus, et empêcher le tire-bouchon de conduire le processus d'infection. Le peptide, lui-même un tire-bouchon, essentiellement des fermetures éclair avec les tire-bouchons du virus, créant un faisceau serré de six formes de tire-bouchon.
Le nouveau peptide persiste plus longtemps dans le corps, ce qui en fait environ trois fois plus efficace pour bloquer l'infection dans les modèles de maladie des rongeurs que la forme originale.
L'équipe de recherche a commencé par essayer de concevoir le peptide d'origine pour qu'il soit plus résistant aux enzymes de digestion des protéines dans le corps, qui peut facilement déchiqueter les protéines et les rendre inutiles. Donc, le laboratoire Gellman s'est tourné vers des blocs de construction inhabituels pour créer un peptide plus résistant.
Les cellules construisent des protéines à partir d'acides aminés alpha. Mais les chimistes peuvent créer des acides aminés bêta, qui sont similaires mais ont un atome de carbone supplémentaire. Lorsque les peptides utilisent ces blocs de construction d'acides aminés bêta, ils prennent souvent une forme différente à cause de l'atome supplémentaire. Cela peut aider un peptide à se cacher des enzymes de digestion des protéines et à survivre plus longtemps.
Cependant, les chercheurs savaient également que si la forme du peptide changeait trop en raison de ces blocs de construction inhabituels, ils pourraient ne pas se verrouiller avec la protéine de fusion tire-bouchon de HPIV.
C'est là que les décennies d'expérience du laboratoire Gellman dans les tests et la modification de peptides contenant des acides aminés bêta sont devenues essentielles.
"Nous savons quel côté du peptide se lie à sa cible protéique. Donc, nous (savions que nous) ne pouvons modifier que les résidus qui ne sont pas directement impliqués dans la liaison de la protéine virale, " dit Victor Hors-la-loi, un chercheur postdoctoral au laboratoire et l'un des co-premiers auteurs du rapport. Dans les tests en laboratoire, ils ont vu que le peptide soigneusement modifié se liait toujours fortement à la protéine du virus.
Dans une autre amélioration lancée par le laboratoire Moscona-Porotto, les scientifiques ont accroché le peptide à une molécule de cholestérol. Cet ajout gras aide le peptide à glisser dans la membrane cellulaire graisseuse, où il peut le mieux bloquer le virus.
"Notre hypothèse était que la combinaison d'acides aminés bêta et de cholestérol augmenterait l'efficacité anti-virale, " dit Hors-la-loi, qui a expliqué que le cholestérol aidait à amener le peptide là où il devait aller, tandis que le changement de forme des acides aminés bêta a permis au peptide de persister plus longtemps dans le corps.
Comme l'espérait l'équipe de recherche, lorsqu'ils ont donné le nouveau peptide à des rats de coton, il a duré beaucoup plus longtemps dans les poumons que la version précédente grâce à sa résistance à la digestion par les enzymes. Le peptide a été délivré dans le nez des rats.
Pour tester l'efficacité du peptide à prévenir l'infection, des rats de coton ont reçu le nouveau peptide avant d'être exposés à HPIV3. Par rapport aux animaux n'ayant reçu aucun peptide antiviral, ceux qui ont reçu le peptide amélioré avaient 10 fois moins de virus dans leurs poumons.
Et comparé au peptide qui était plus sensible aux enzymes, le peptide le plus résistant a réduit la charge virale d'environ trois fois, suggérant que la capacité du nouveau peptide à éviter la digestion dans le corps l'aide à mieux bloquer l'infection.
Bien que l'approche n'ait pas encore été testée chez l'homme et que les chercheurs doivent encore affiner et tester le système, il fournit une nouvelle stratégie pour potentiellement prévenir ou traiter ces infections courantes.
La collaboration de recherche cherche maintenant à fabriquer des peptides de deuxième génération qui durent encore plus longtemps dans le corps. Ils veulent également tester dans quelle mesure le peptide modifié pourrait bloquer l'infection par des virus apparentés. Cette recherche supplémentaire pourrait rapprocher le traitement peptidique des essais cliniques.
« Ce fut une réunion très chanceuse de groupes qui avaient des besoins et des capacités complémentaires, " dit Gellman. " C'est vraiment un grand effort commun. "