Hypothèse de construction membranaire biocatalytique inspirée du modèle de mosaïque fluide de la structure membranaire cellulaire. Crédit :ZHANG Hao
Les micropolluants tels que les perturbateurs endocriniens, les pesticides et les produits pharmaceutiques ont des effets néfastes sur la santé publique et les écosystèmes aquatiques, même au niveau des traces. Les membranes biocatalytiques présentent une efficacité élevée d'élimination des micropolluants grâce à l'intégration de la catalyse enzymatique et de la séparation membranaire.
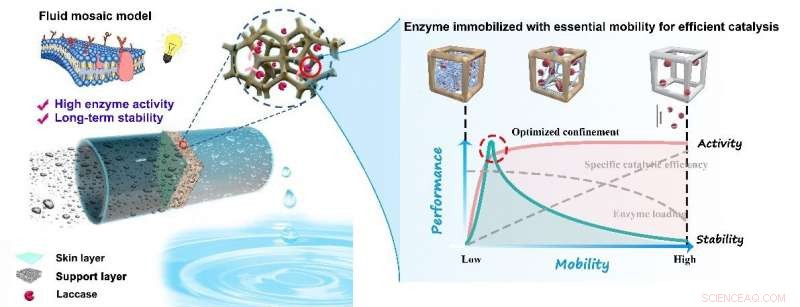
Atteindre une stabilité à long terme et une efficacité catalytique élevée en même temps reste un défi dans la fabrication de membranes biocatalytiques. Inspiré du modèle de mosaïque fluide de la structure de la membrane cellulaire, un groupe de recherche dirigé par le professeur Wan Yinhua de l'Institut de génie des procédés (IPE) de l'Académie chinoise des sciences a préparé une nouvelle membrane biocatalytique avec une activité enzymatique et une stabilité élevées pour l'élimination des micropolluants. L'étude a été publiée dans le Revue de génie chimique le 28 novembre.
Les chercheurs ont réglé la force de confinement de la membrane, régulant ainsi la mobilité de l'enzyme immobilisée via une modification tridimensionnelle (3-D) de la couche de support de la membrane de nanofiltration.
Un revêtement inspiré des moules a été appliqué pour modifier l'ensemble de la couche de support de la membrane de nanofiltration (appelée modification 3-D), et la laccase a ensuite été restreinte de manière non covalente dans une membrane de nanofiltration modifiée par filtration inverse.
"La laccase peut être stabilisée dans la couche de support modifiée en 3D de la membrane de nanofiltration avec une distribution uniforme, charge élevée en enzymes, et une stabilité de stockage ultra-élevée. De plus, la membrane de nanofiltration modifiée est polyvalente pour différentes immobilisations enzymatiques, " a déclaré le professeur Wan.
Encore mieux, cette stratégie de modification 3-D inspirée des moules a amélioré la force de confinement de la membrane à l'enzyme avec peu d'augmentation de la résistance au transfert de masse pour le substrat et les produits, qui a efficacement retardé la fuite de l'enzyme et en même temps doté l'enzyme d'un niveau de mobilité pour une catalyse efficace.
La membrane biocatalytique préparée avec une force de confinement optimisée présentait une activité catalytique élevée et une stabilité à long terme dans sept cycles de réutilisation et 36 heures de fonctionnement continu pour l'élimination des micropolluants.
Les chercheurs ont également proposé un protocole simple pour quantifier la mobilité de l'enzyme immobilisée, qui pourrait refléter précisément la force de confinement des membranes modifiées, ainsi que les performances catalytiques des membranes biocatalytiques.
De plus, la membrane modifiée pourrait servir de stockage d'enzymes et de dispositif à libération prolongée contrôlable pour la réaction et le dosage. "Ce travail offre non seulement une plate-forme polyvalente pour immobiliser diverses enzymes et préparer une membrane biocatalytique supérieure, " a déclaré le professeur Luo Jianquan de l'IPE, "mais fournit également des conseils pour concevoir un environnement de confinement optimal pour les enzymes dans la membrane, faciliter les applications potentielles de la membrane biocatalytique dans la bioconversion améliorée, l'administration de médicaments, et des biocapteurs à petite échelle."