Cristaux de CODH/ACS obtenus sans oxygène. La couleur brune provient des métaux naturels hébergés par les protéines. Crédit :Institut Max Planck de microbiologie marine/T. Wagner
Les gaz résiduaires de nombreuses branches de l'industrie contiennent principalement du monoxyde de carbone et du dioxyde de carbone. De nos jours, ces gaz sont simplement soufflés dans notre atmosphère, mais cela pourrait bientôt changer. L'idée est d'utiliser le pouvoir des bactéries pour transformer les gaz résiduaires toxiques en composés précieux tels que l'acétate ou l'éthanol. Ceux-ci peuvent être utilisés par la suite comme biocarburants ou composés de base pour les matériaux synthétiques. Les premières usines d'essai en taille réelle sont déjà en cours d'évaluation, en utilisant cette conversion à l'échelle industrielle, et les étoiles de ces processus sont des bactéries qui dévorent le monoxyde de carbone, dioxyde de carbone et dihydrogène, parmi lesquels Clostridium autoethanogenum est de loin le favori.
"Dans ce microbe, les grandes lignes du métabolisme utilisées pour opérer la conversion du gaz ont été caractérisées, " dit Tristan Wagner, chef du groupe Métabolisme microbien à l'Institut Max Planck de microbiologie marine. "Mais il y a encore beaucoup de points d'interrogation au niveau moléculaire." L'objectif des scientifiques de Brême :comment le monoxyde de carbone toxique est-il traité par les enzymes avec une efficacité aussi étonnante ?
Grosse surprise dans un cristal
La connaissance au niveau moléculaire de la conversion du monoxyde de carbone est dérivée d'études réalisées sur l'espèce Moorella thermoacetica. Il s'agit d'un organisme modèle marin pratique et bien étudié, mais qui présente une faible capacité à détoxifier les gaz résiduaires, contrairement à Clostridium autoethanogenum. Les deux bactéries utilisent la même enzyme pour convertir le monoxyde de carbone :la CO-déshydrogénase/Acétyl-CoA synthase, abrégé en CODH/ACS. C'est une enzyme très courante qui existait déjà dans les temps primitifs de la terre. "Comme les deux espèces utilisent la même enzyme pour convertir le monoxyde de carbone, nous nous attendions à voir exactement la même structure avec éventuellement des différences mineures, " dit Wagner.
Pour leurs recherches, Wagner et son collègue Olivier N. Lemaire étudient la bactérie Clostridium autoethanogenum pour comprendre comment elle peut prospérer à la thermodynamique de la Vie, utilisant un métabolisme similaire à celui des premières formes vivantes. Olivier N. Lemaire a cultivé la bactérie et purifié son CODH/ACS en absence d'oxygène, ce qui est préjudiciable à l'enzyme. Les deux scientifiques ont utilisé la méthode de cristallisation pour obtenir des cristaux de l'enzyme CODH/ACS et déterminer la structure 3-D de la protéine par cristallographie aux rayons X. "Quand nous avons vu les résultats, nous n'en croyions pas nos yeux, " dit Wagner. " L'interface CODH-ACS de Clostridium autoethanogenum diffère radicalement du modèle de Moorella thermoacetica, même s'il s'agissait de la même enzyme et de bactéries similaires."
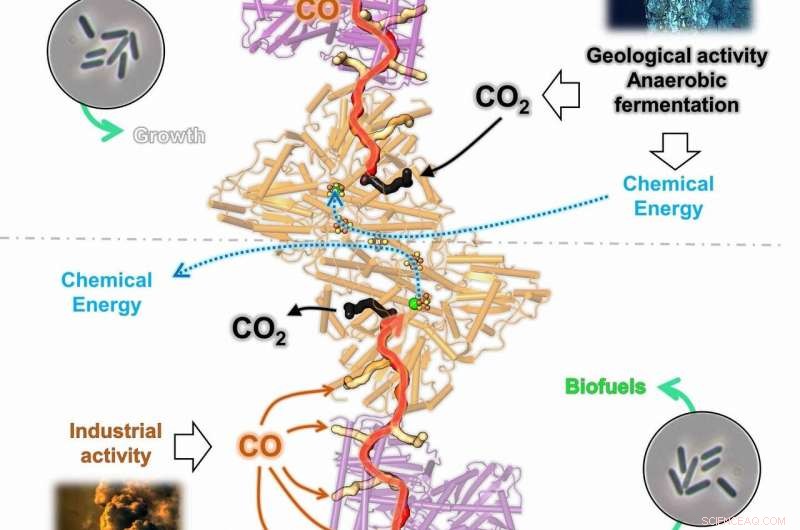
Le graphique montre la bidirectionnalité du complexe CODH/ACS de C. autoethanogenum (CODH en orange et ACS en violet). Dans des conditions chimiolithoautotrophes, l'enzyme peut transformer le dioxyde de carbone (CO2) en monoxyde de carbone (CO), séquestré dans un canal de gaz (en haut). Le CO sera transformé en acétyl-CoA, le bloc de construction de la cellule utilisé pour obtenir l'énergie cellulaire et construire le matériau cellulaire. Pendant le processus de conversion du gaz, le CO dégagé par l'activité industrielle peut être utilisé très efficacement par le CODH/ACS (en bas). Il est capté par les nombreux canaux gazeux et générera à la fois de l'acétyl-CoA et de l'énergie chimique, permettant à la cellule de vivre du CO. Crédit :O. Lemaire et T. Wagner. L'image non protégée par le droit d'auteur utilisée a été obtenue auprès de la National Oceanic and Atmospheric Administration (NOAA) et de la photothèque Pexel (Black Smoker; NOAA Office of Ocean Exploration and Research, 2016 Exploration en eaux profondes des Mariannes ; Photographie d'usine par Chris LeBoutillier
Mêmes ingrédients, architecture différente
Après, les deux chercheurs ont mené d'autres expériences pour prouver que la première structure n'était pas un artefact mais la réalité biologique. Les expériences suivantes ont confirmé le modèle initial. Ainsi, la découverte prouve clairement fausse l'hypothèse précédente selon laquelle l'enzyme CODH/ACS a toujours la même structure globale. "L'enzyme de Moorella thermoacetica a une forme linéaire, " explique Olivier N. Lemaire, premier auteur de l'étude, qui a été récemment publié dans la revue scientifique BBA Bioénergétique . « A Moorella thermoacetica, l'enzyme produit du monoxyde de carbone dans le CODH et l'utilise dans l'ACS. Entre eux, il est piégé et canalisé à travers un canal de gaz scellé. ACS synthétisera à terme l'acétyl-CoA, un bloc de construction transformé en acétate et en éthanol. Le reste de la cellule ne voit pas de monoxyde de carbone."
Mais Clostridium autoethanogenum absorbe directement le monoxyde de carbone. « Chez Clostridium autoethanogenum, l'enzyme CODH/ACS n'a pas qu'une seule ouverture, mais plusieurs. De cette façon, il peut collecter autant de monoxyde de carbone que possible et le conduire dans tout un système de tunnels, fonctionnant dans les deux sens, " dit Lemaire. " Ces résultats montrent un remaniement des gaz-tunnels internes au cours de l'évolution de ces bactéries, conduisant putativement à un complexe bidirectionnel qui assure un flux élevé de conversion de monoxyde de carbone vers la conservation de l'énergie et l'assimilation du monoxyde de carbone, agissant comme la principale centrale électrique cellulaire. » À la fin du processus, de l'acétate et de l'éthanol sont également générés, qui peuvent être utilisés pour produire des carburants.
« Nous avons maintenant une idée de ce à quoi ressemble cette enzyme très efficace et robuste, " dit Tristan Wagner. " Mais notre découverte n'est qu'un pas de plus. Entre autres, la question reste ouverte de savoir comment la bactérie peut survivre et utiliser le monoxyde de carbone pour nourrir l'ensemble de ses besoins énergétiques cellulaires. Nous avons quelques hypothèses, mais nous sommes encore au début. Pour comprendre l'ensemble du processus chimique de conversion du monoxyde de carbone en acétate et en éthanol, d'autres protéines doivent être étudiées."