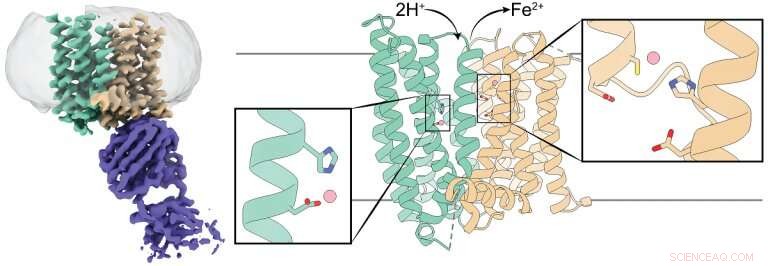
Structure 3D d'une ferroportine de mammifère. Le panneau de gauche montre une carte de densité cryo-EM de la ferroportine (sarcelle et marron) en complexe avec un anticorps (violet). Les panneaux du centre et de droite montrent une représentation caricaturale de la ferroportine avec ses domaines N et C colorés en bleu sarcelle et marron, respectivement. Chaque domaine a un site de liaison des ions fer marqué par un rectangle, et les résidus qui coordonnent les ions fer sont représentés par des bâtons. Crédit :Jiemin Shen/Zhou lab/ Communication Nature , 2020.
Trop ou trop peu de fer dans le corps peut entraîner des maladies, mais les organismes ont développé des moyens de maintenir les niveaux de fer en équilibre. Ferroportine, le seul exportateur de fer connu qui libère du fer dans la circulation sanguine, est un élément crucial des mécanismes d'équilibrage du fer.
Cherchant à mieux comprendre la régulation du fer, une équipe dirigée par des chercheurs du Baylor College of Medicine a analysé la structure 3-D d'une ferroportine de mammifère, révélant des caractéristiques inattendues et un nouveau mode d'action pouvant guider le développement de stratégies thérapeutiques innovantes. L'étude apparaît dans Communication Nature .
"Plus de 60 mutations du gène de la ferroportine ont été associées à des maladies humaines. Certaines de ces mutations rendent la ferroportine insensible à l'hepcidine, une hormone peptidique synthétisée dans le foie qui contribue à la régulation de la ferroportine, " a déclaré l'auteur correspondant, le Dr Ming Zhou, Ruth McLean Bowman Bowers Professeur de biochimie et de biologie moléculaire. Zhou est également membre du Dan L Duncan Comprehensive Cancer Center à Baylor.
La ferroportine et l'hepcidine coordonnent leurs activités pour maintenir le fer dans le corps dans le bon équilibre. La ferroportine exporte du fer dans le sang, et l'hepcidine contrôle que les exportations ne dépassent pas les besoins. Lorsqu'il ne répond pas à l'hepcidine, la ferroportine reste active. Par conséquent, le corps est chargé de fer, une condition appelée maladie de surcharge en fer.
"Nous aimerions mieux comprendre le processus de régulation du transport du fer en regardant la structure de la ferroportine, " a déclaré le co-premier auteur, le Dr Yaping Pan, professeur adjoint de biochimie et de biologie moléculaire à Baylor. "Ni la structure de la ferroportine ni la structure de la ferroportine et de l'hepcidine ensemble n'ont été décrites. Un examen plus approfondi de ces structures fournirait de nouvelles informations sur le fonctionnement de la ferroportine et sur la manière dont l'hepcidine régule son activité, ouvrant des possibilités pour de nouvelles approches pour traiter la maladie de surcharge en fer."
Une protéine difficile
Les chercheurs ont étudié la ferroportine du primate tarsier des Philippines, qui est similaire à plus de 90 pour cent à la ferroportine humaine. Des études antérieures portant sur la ferroportine bactérienne et d'autres transporteurs de fer ont montré que ces protéines n'ont qu'un seul site de liaison au fer, ils portent un groupe de fer à la fois.
"Nous avons commencé notre étude en supposant que la ferroportine de tarsier avait également un site de liaison au fer et nous étions assez intrigués par les résultats de nos expériences, " a déclaré le co-premier auteur Jiemin Shen, étudiant diplômé en biosciences quantitatives et computationnelles au laboratoire de Zhou.
Par exemple, l'équipe a mené des expériences pour déterminer comment la modification du site de liaison du fer affecterait la structure 3-D de la ferroportine. Ils ont été intrigués lorsqu'ils ont découvert que la modification du site ne semblait pas avoir beaucoup d'effet, le contraire de ce qu'ils attendaient. Une fois que nous avons révélé la structure de la ferroportine par cryomicroscopie électronique, nous avons réalisé qu'il a deux sites de fixation du fer. C'était une surprise qui expliquait les données qui nous avaient intrigués."
"Nous ne modifiions qu'un seul site et il semble que l'autre site était encore à l'œuvre pour lier le fer, donc nous n'avons pas vu beaucoup de changement sur la structure de la ferroportine, " dit Shen.
Une deuxième découverte vraiment passionnante était que le mode d'action de la ferroportine de tarsier est différent de ceux rapportés pour d'autres transporteurs de fer, " dit Zhou.
"Les exportations de ferroportine d'ions de fer portent deux charges électriques positives. Nous avons constaté que lorsque la ferroportine exporte des ions de fer, protons, qui ont une charge positive, sont transportés dans la cellule, équilibrer les charges et faciliter la poursuite des exportations de fer, " dit Pan.
« Nous utilisons ces nouvelles découvertes structurelles et fonctionnelles pour identifier de petites molécules candidates qui peuvent réguler la ferroportine. Nous étudions également la ferroportine humaine, " a déclaré Zhou. " Ce projet a un bon potentiel pour traduire les résultats au chevet du patient. "