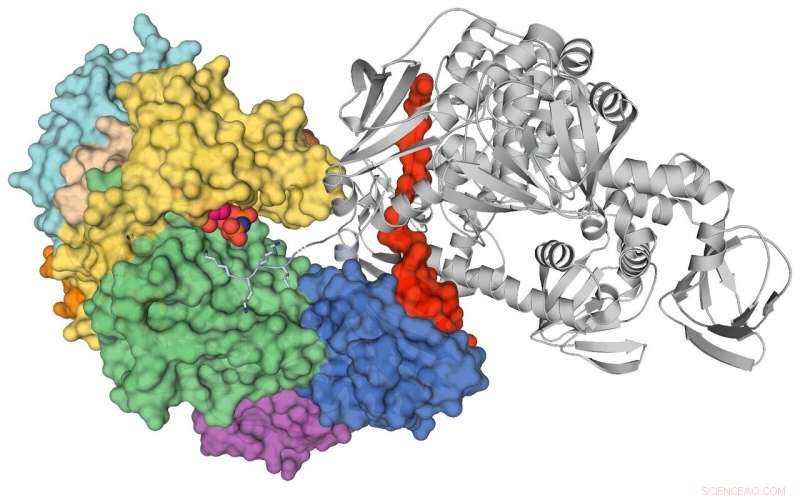
Cristal PKG. Crédit :Source de lumière canadienne
Le paludisme est endémique dans de vastes régions d'Afrique, Asie et Amérique du Sud et tue chaque année plus de 400, 000 personnes, dont une majorité d'enfants de moins de 5 ans, avec des centaines de millions de nouvelles infections chaque année.
Bien que des combinaisons de médicaments à base d'artémisinine soient disponibles pour traiter le paludisme, des rapports d'échecs de traitement provenant d'Asie du Sud-Est suscitent des inquiétudes quant à la propagation de la résistance aux médicaments en Afrique. Heureusement, il y a de l'espoir à l'horizon car il y a plusieurs nouveaux candidats médicaments antipaludiques en cours d'essais cliniques ainsi que d'autres cibles médicamenteuses prometteuses qui sont à l'étude.
Une équipe de recherche internationale a pour la première fois déterminé la structure atomique d'une protéine kinase appelée PKG dans les parasites Plasmodium qui causent le paludisme, une découverte qui contribuera potentiellement à créer une nouvelle génération de médicaments antipaludiques et à faire avancer la recherche fondamentale.
PKG joue un rôle essentiel dans les étapes de développement du cycle de vie complexe du parasite, il est donc essentiel de comprendre sa structure pour développer des thérapies antipaludiques qui ciblent spécifiquement la PKG et non d'autres enzymes humaines, selon le chercheur Dr Charles Calmettes.
"Jusqu'à maintenant, nous n'avions la structure pour PKG d'aucun organisme. Il existe des différences entre la PKG humaine et la PKG du paludisme, mais jusqu'à présent, c'est le meilleur modèle dont nous disposons pour comprendre la version mammifère de la protéine, " dit Calmettes, professeur adjoint à l'INRS-Institut Armand-Frappier à Québec.
De puissants inhibiteurs de la PKG de première génération ont été fabriqués qui ciblent sélectivement la PKG du parasite, mais pas la PKG humaine en raison d'une différence structurelle significative entre les deux enzymes dans la poche de liaison à l'inhibiteur révélée par des études de cristallographie.
La ligne de lumière CMCF de Canadian Light Source à l'Université de la Saskatchewan a permis aux chercheurs d'optimiser les cristaux PKG et de collecter les premiers ensembles de données pour le projet.
« Avoir accès au puissant faisceau de rayons X pour collecter des données de diffraction et cribler les cristaux de protéines au CLS était très important pour mener à bien notre projet, " il a dit, l'ajout d'une grande partie de l'élucidation de la structure des protéines a été effectué par des chercheurs du Structural Genomics Consortium de l'Université de Toronto.
Lorsqu'un moustique infecté pique un humain, les parasites du paludisme sont rapidement transportés vers le foie, où ils envahissent les cellules hépatiques (hépatocytes) et se multiplient. Les hépatocytes éclatent, libérant des dizaines de milliers de parasites transformés (mérozoïtes) qui envahissent les globules rouges. Là, les mérozoïtes se multiplient et rompent les cellules sanguines - un processus qui produit de la fièvre, des frissons, nausées et autres effets désagréables du paludisme.
Un moustique qui se nourrit du sang d'un humain infecté attrapera le parasite et transmettra la maladie à d'autres humains, qui continue le cycle mortel.
Des expériences antérieures ont montré que plusieurs stades de développement du parasite dépendent de la PKG, qui contrôle la signalisation du calcium dans les cellules. Les signaux calciques régulent les activités cellulaires, y compris le moment précis de la libération des mérozoïtes des cellules sanguines, et les processus de réplication des parasites au sein du moustique.
« PKG est une bonne cible médicamenteuse car vous pouvez cibler les étapes du cycle de vie du parasite qui provoquent les symptômes de la maladie, mais aussi celles qui transmettent la maladie par les moustiques, empêchant ainsi le parasite de provoquer une maladie chez l'hôte humain. Des expériences ont montré que lorsque vous ajoutez un inhibiteur de PKG aux stades transmissibles (gamétocytes), le parasite n'est pas capable de se développer dans le moustique et d'infecter un nouvel hôte, " dit Calmette.