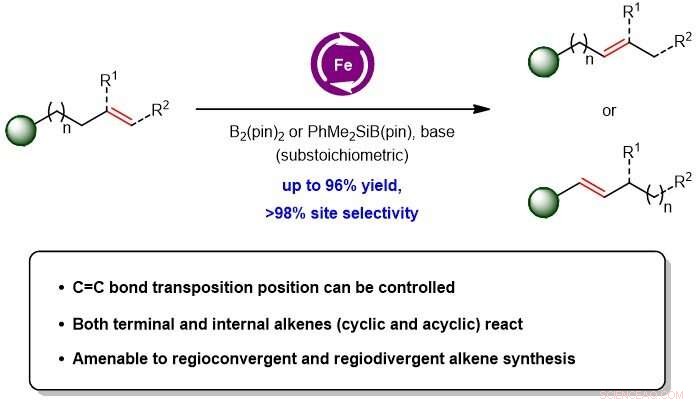
Figure 1 :Le schéma montrant la migration de la liaison C=C dans les alcènes peut être réalisé en utilisant une catalyse au fer avec des quantités inférieures à la stoechiométrie d'une base et d'un réactif boryle. Crédit: Journal de l'American Chemical Society
Les chimistes du NUS ont découvert un moyen de contrôler la position des doubles liaisons carbone-carbone (C=C) dans l'isomérisation des oléfines en utilisant une catalyse durable à base de fer pour des applications potentielles en synthèse organique.
L'isomérisation catalytique des liaisons C=C est une transformation chimique indispensable utilisée pour fournir des analogues de plus grande valeur. Il a des utilisations importantes dans l'industrie chimique. Bien qu'un grand nombre de protocoles de migration de liaisons C=C catalysées par des métaux aient été développés, des lacunes persistantes ne sont pas résolues. La capacité de repositionner les liaisons C=C au sein des oléfines, connu sous le nom de transposition d'alcène, est une approche efficace pour obtenir des formes structurellement isomères de la même molécule à partir d'un seul substrat. Cependant, cela continue d'être un défi formidable. Séparément, la conversion de mélanges d'alcènes régioisomères qui contiennent de nombreux isomères du même composé en un seul produit n'ayant qu'un seul isomère, n'est pas encore atteint. Cette conversion est particulièrement utile pour rationaliser la synthèse chimique.
Une équipe de recherche dirigée par le professeur Koh Ming Joo, du Département de chimie, NUS a mis au point une nouvelle technique d'isomérisation des oléfines dans laquelle des quantités catalytiques d'un complexe à base de fer abondant en terre, une base et un composé boryle sont utilisés pour favoriser une transposition efficace et contrôlable de l'alcène (voir figure 1). Cette méthode peut être utilisée pour les substrats alcènes terminaux et internes. Des études mécanistiques menées par l'équipe ont révélé que ces transformations chimiques sont susceptibles de passer par un intermédiaire catalytique d'hydrure de fer qui induit la migration des liaisons C=C.
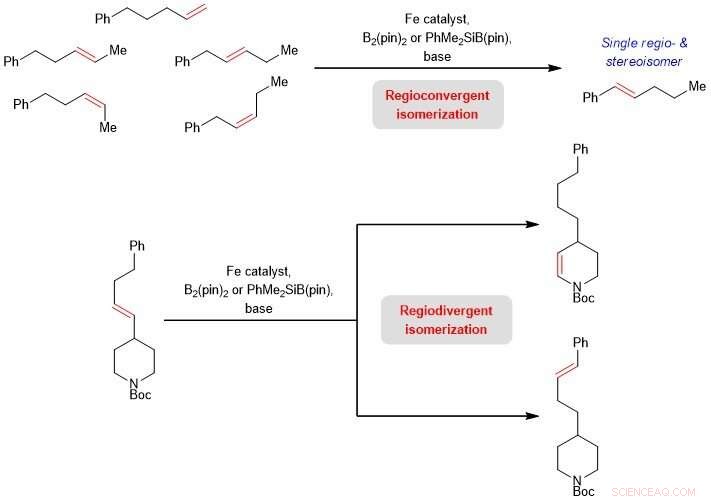
Figure 2 :Schéma montrant la capacité de la catalyse à base de fer à favoriser l'isomérisation des oléfines régioconvergentes (produit un seul composé à partir de ses formes isomères) et régiodivergentes (produit des formes structurellement isomères du même composé). Crédit: Journal de l'American Chemical Society
Le professeur Koh a dit, "Le nouveau régime catalytique permet d'obtenir des produits structurellement différents à partir d'un seul substrat. Notre équipe a également découvert que la catalyse à base de fer peut également être utilisée pour transformer des mélanges d'oléfines isomères, que l'on trouve couramment dans les charges d'alimentation dérivées du pétrole d'un seul alcène destiné à être utilisé par l'industrie pétrochimique. Cette avancée scientifique ne met pas seulement en évidence une nouvelle approche pour la marche des chaînes d'alcènes. Il illustre également la viabilité de contrôler où la liaison C=C migre même dans des substrats portant au moins deux sites possibles qui peuvent diriger l'isomérisation de l'oléfine. Cela a des implications importantes pour faciliter la synthèse de fragments insaturés intégrés dans des composés biologiquement actifs. »
L'équipe de recherche prévoit de combiner cette nouvelle méthodologie avec des réactions d'addition d'oléfines pour développer de nouvelles transformations de fonctionnalisation.
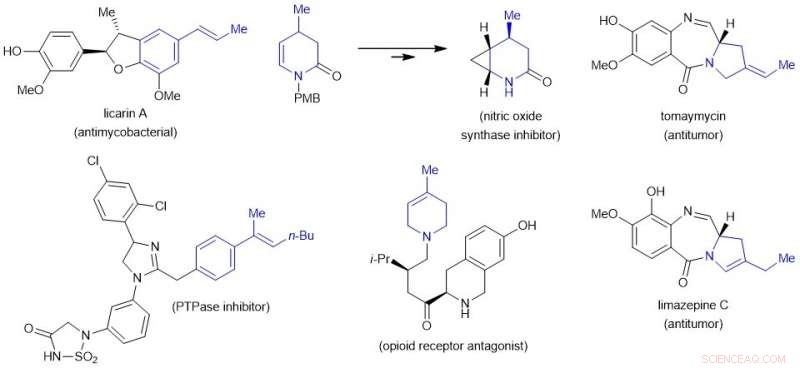
Figure 3 :Schéma montrant des alcènes intégrés dans des composés biologiquement actifs et leurs précurseurs. Crédit :Journal de l'American Chemical Society