Crédit :Université de Californie, Los Angeles
Les Tang, Garg, et les groupes de recherche Houk ont découvert les catalyseurs naturels de protéines (enzymes) qui catalysent la réaction Alderène.
Tous les groupes font partie du département de chimie et biochimie de l'UCLA. Le professeur Yi Tang est professeur chancelier au département de génie chimique et biomoléculaire de l'UCLA et occupe également un poste conjoint au département de bioingénierie. Le professeur Ken Houk est titulaire de la chaire de recherche distinguée Saul Winstein en chimie organique et le professeur Neil Garg est titulaire de la chaire Kenneth N. Trueblood Endowed en chimie et biochimie et occupe le poste de directeur du département.
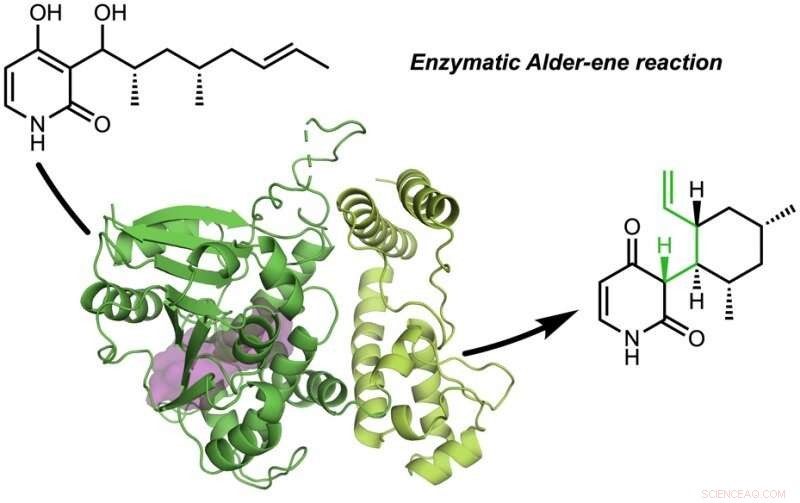
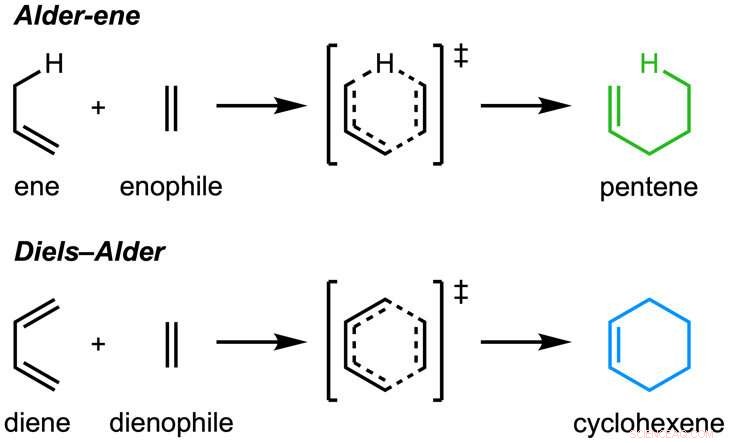
Le papier, "Une réaction enzymatique Alder-ene" a été publié dans La nature . La réaction d'Alderène a été découverte en 1943, mais jusqu'à présent n'a été utilisé que pour la synthèse chimique en laboratoire. La réaction Alder-ène est un exemple de réaction péricyclique et un analogue de la réaction de Diels-Alder bien connue. Précédemment, Tang et Houk ont identifié une nouvelle classe d'enzymes, les péricyclases, pour leur capacité à accélérer les réactions péricycliques dans le métabolisme primaire et secondaire.
En collaboration avec Jiahai Zhou de l'Institut de chimie organique de Shanghai, les groupes Tang-Garg-Houk ont rapporté les structures et les mécanismes de deux groupes d'enzymes qui catalysent une déshydratation stéréosélective et une réaction péricyclique concomitante, indiqué ci-dessous, où les petits symboles comme PdxI indiquent des enzymes naturelles (catalyseurs de protéines) découvertes par le groupe Tang. Un groupe d'enzymes catalyse une réaction Alderène, et le second catalysent les réactions hétéro-Diels-Alder.
Crédit :Université de Californie, Los Angeles

Crédit :Université de Californie, Los Angeles
L'article décrit la synthèse divergente de la pyridoxatine et de l'asperpyridone A. En partant du substrat alcoolique, les enzymes facilitent une déshydratation pour former un intermédiaire réactif de quinone méthide à partir duquel les squelettes de pyridoxatine et d'asperpyridone A peuvent se former par réaction d'Alderène ou de Diels-Alder. Masao Ohashi dans le groupe Tang, et Cooper Jamieson dans les groupes Houk et Tang ont travaillé ensemble pour identifier les facteurs dans les enzymes qui contrôlent quelle réaction se produit. Les prédictions informatiques ont guidé les modifications expérimentales qui ont modifié les enzymes afin de catalyser l'autre réaction. Ce type d'ingénierie des protéines promet d'influencer à l'avenir la synthèse en laboratoire de produits naturels apparentés.
Crédit :Université de Californie, Los Angeles
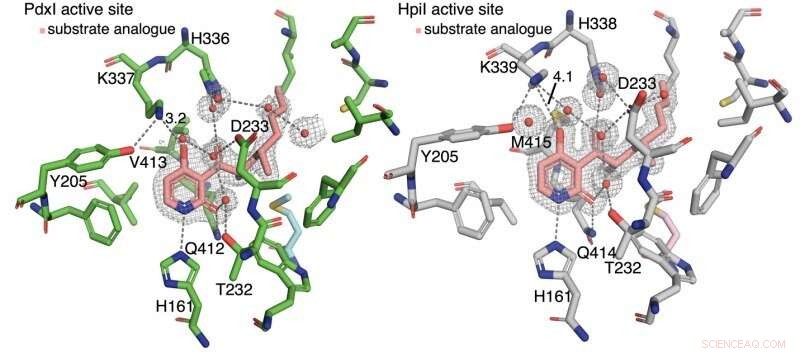
Les auteurs ont découvert que la liaison hydrogène à la pyridone C4 contrôle le type de réaction. Dans les enzymes PdxI, AdxI, et MdxI, un résidu lysine (K337) lie l'hydrogène à C4. Cela diminue la nucléophilie de l'oxygène et défavorise la réaction hétéro-Diels-Alder. PdxI, AdxI, et MdxI utilisent cette stratégie pour former sélectivement le squelette de la pyridoxatine. Enzymes EpiI, UpiI, et HpiI bloque l'apparition de cette liaison hydrogène avec un résidu méthionine flexible (M415) et facilite ainsi la formation du squelette A d'asperpyridone. Cette différence géométrique subtile dans les sites actifs provoque un changement électronique assez important dans le substrat et contrôle la réaction péricyclique enzymatique.