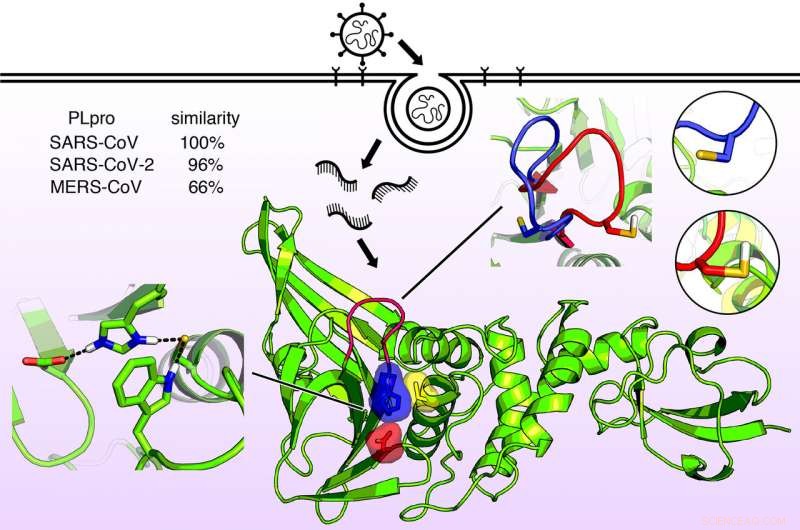
Structure moléculaire de l'enzyme papaïne connue sous le nom de PLPro. Cette enzyme permet aux virus qui causent le SRAS, MER, et COVID-19 pour infecter les cellules et répliquer et supprimer la fonction immunitaire de l'hôte. Maintenant que la structure de l'enzyme est connue en détail, de nouveaux médicaments antiviraux peuvent être conçus. Crédit :Jack Henderson, École de pharmacie de l'Université du Maryland
COVID-19 est causé par un virus connu sous le nom de SARS-CoV-2, dont la structure est similaire à celle de deux autres virus qui ont provoqué des épidémies récentes :le SRAS-CoV, qui a provoqué une épidémie de SRAS en 2003, et MERS-CoV, cause d'une épidémie de syndrome respiratoire du Moyen-Orient en 2012.
Dans le Journal de physique chimique , des scientifiques de la faculté de pharmacie de l'Université du Maryland rapportent des études au niveau moléculaire sur ces trois virus, offrant une voie possible à de nouveaux médicaments antiviraux pour lutter contre les trois maladies. Au moment présent, aucun traitement ou médicament efficace n'existe pour aucune de ces maladies à coronavirus.
Les chercheurs ont examiné une protéine virale qui joue un rôle clé dans la capacité du virus à se répliquer une fois à l'intérieur du corps. Cette protéine joue également un rôle dans la défaite du système immunitaire de l'hôte, il constitue donc une cible particulièrement attractive pour des traitements médicamenteux potentiels.
La protéine, une enzyme connue sous le nom de protéase de type papaïne, PLPro, est presque identique dans le SARS-CoV-2 et le SARS-CoV mais est légèrement différent dans le MERS-CoV. Très récemment, la première radiographie structurelle de cette enzyme a révélé une forme dans le domaine catalytique un peu comme une main avec un "pouce, " " la paume, " et " les doigts ".
Le pouce et la paume se rejoignent pour former un site de liaison, où une molécule médicamenteuse pourrait potentiellement être capturée. Les doigts se replient sur cette région et assurent une intégrité structurelle essentielle à l'activité PLPro.
Les chercheurs ont découvert que de petits changements de pH pourraient changer la forme de cette enzyme grâce à un processus connu sous le nom de protonation, où les ions hydrogène se lient à certaines unités d'acides aminés dans la protéine.
"Le commutateur d'état de protonation est un mécanisme de transduction d'énergie important, " a déclaré l'auteur Jana Shen.
Le co-auteur Jack Henderson a déclaré :"La protéine de pointe du coronavirus, par exemple, utilise des commutateurs d'état de protonation pour induire d'importants changements de conformation requis pour la fusion membranaire."
La fusion membranaire est la première étape de l'infection. Un virus se fixe à la membrane externe d'une cellule, se frayant un chemin à l'intérieur où il peut commencer à former des copies de lui-même qui se répandent dans tout le corps.
Une autre caractéristique clé du site de liaison PLpro est une chaîne d'unités d'acides aminés appelée boucle BL2. Les chercheurs ont découvert que cette boucle peut s'ouvrir ou se fermer dans les virus du SRAS lorsqu'un acide aminé particulier de la boucle est soit protoné, soit déprotoné. Dans le virus MERS, cependant, la boucle est flexible même sans un tel acide aminé.
Cette caractéristique suggère qu'un médicament potentiel pourrait cibler la boucle BL2, l'amenant à se fermer et à se lier étroitement à un inhibiteur viral.
"Notre travail fournit un point de départ pour d'autres investigations mécanistiques utilisant des approches de plus haut niveau, " dit Shen.