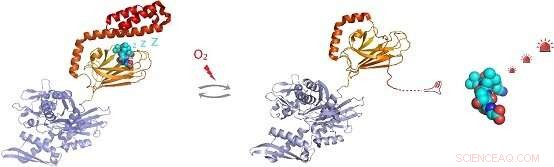
Figure :Dans des conditions de stress oxydatif, le chaperon moléculaire Hsp70 subit une modification post-traductionnelle des résidus cystéine par addition du tripeptide glutathion. La glutathionylation dans le domaine de liaison au substrat de Hsp70 provoque le dénouement de la région hélicoïdale C-terminale de Hsp70 et l'occupation de son propre site de liaison au substrat. Cela empêche la liaison, permettant l'activation de substrats de molécules de signalisation tels que le facteur de transcription de choc thermique Hsf1. Crédit :Groupe du Dr Sarah Perrett
Les protéines de choc thermique 70 (Hsp70) sont une famille de chaperons moléculaires anciens et conservés. Ils jouent un rôle essentiel dans le maintien de l'homéostasie des protéines, y compris faciliter le repliement et la dégradation des protéines, prévenir l'agrégation des protéines, et participer à la réponse au stress. La perturbation de la machinerie de contrôle de qualité cellulaire est associée au vieillissement, cancers et maladies neurodégénératives.
Le rôle des modifications post-traductionnelles (PTM) dans la régulation des fonctions de Hsp70 est un domaine de recherche émergent. Bien que le stress oxydatif puisse être nocif, la variation redox est une caractéristique naturelle de l'environnement cellulaire et facilite la transduction du signal pour des activités physiologiques importantes. Les modifications de la cystéine des protéines constituent le principal moyen de transfert du signal redox. La glutathionylation est une modification réversible des résidus de cystéine dans les protéines, qui peut protéger les protéines d'une oxydation irréversible, et peut également jouer un rôle dans la transduction du signal.
Dans cette étude, la glutathionylation de différents membres de la famille Hsp70 a été détectée dans les cellules HeLa et les sites de modification ont été déterminés par spectrométrie de masse par des chercheurs du groupe du professeur Sarah Perrett et du professeur Chen Chang à l'Institut de biophysique de l'Académie chinoise des sciences.
En se concentrant sur le stress inductible Hsp70 HspA1A (hHsp70), le mécanisme structurel détaillé de la façon dont la glutathionylation affecte l'activité des protéines et les interactions protéine-protéine a été étudié.
La détection in vivo a montré que chacun des cinq résidus cystéine de hHsp70 peut subir une glutathionylation. Des expériences in vitro ont révélé que la modification des cystéines dans le domaine de liaison aux nucléotides de hHsp70 est empêchée par la liaison aux nucléotides, mais que Cys-574 et Cys-603, situé dans le couvercle -hélicoïdal C-terminal du domaine de liaison au substrat, peut subir une glutathionylation en présence et en l'absence de nucléotide.
En résolvant la structure RMN de la forme glutathionylée du hHsp70 SBD, la base structurelle des changements fonctionnels a été démontrée. La glutathionylation de ces résidus cystéine entraîne le dépliement de la structure de la paupière en hélice . La région dépliée imite le substrat en se liant au site de liaison du substrat et en le bloquant, favorisant ainsi l'activité intrinsèque de l'ATPase, et en concurrence avec la liaison des substrats externes. Cela conduit à une réduction de sa capacité à se lier à d'autres protéines substrats, comme le facteur de choc thermique Hsf1.
Ces résultats indiquent non seulement que la modification de la cystéine peut altérer la structure et la fonction de hHsp70, mais aussi que hHsp70 peut transférer des informations redox à ses clients.
Cette étude a été publiée dans le Journal de chimie biologique le 12 juin 2020.