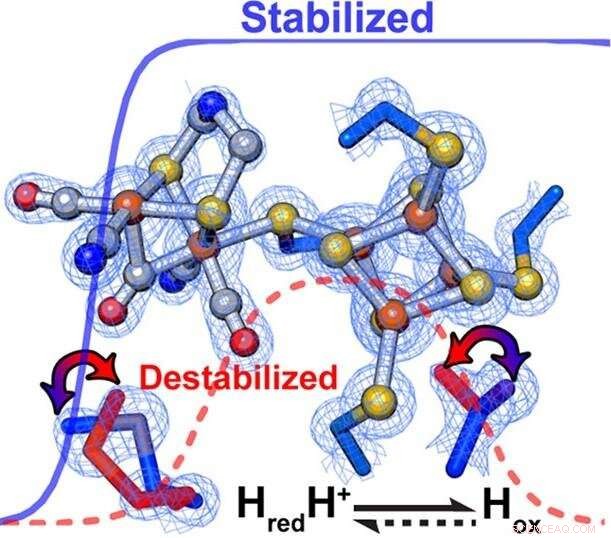
Les chercheurs ont découvert que des changements subtils dans l'échafaudage protéique entourant le centre catalytique d'une enzyme contrôlent parfaitement la vitesse et la direction des réactions chimiques. Au sein des [FeFe]-hydrogénases, les interactions secondaires ont directement influencé la stabilisation/déstabilisation relative des différents états d'oxydation de l'amas métallique du site actif. Crédit :PNNL
Alors que les chercheurs cherchent des moyens de développer et d'améliorer des produits de tous les jours allant du carburant aux médicaments, les enzymes fournissent l'exemple naturel du contrôle nécessaire pour que les réactions chimiques fonctionnent de la manière souhaitée. Mais un phénomène connu sous le nom de biais catalytique continue de bloquer les scientifiques.
L'échafaudage protéique autour du noyau catalytique d'une enzyme contrôle parfaitement la réactivité, y compris la direction et la vitesse des processus chimiques. Les scientifiques appellent ce réglage fin un « biais catalytique », et la manière dont cela se produit reste largement débattue.
Le mystère est sur le point d'être résolu.
Une équipe de recherche de trois laboratoires nationaux du Département de l'énergie des États-Unis (DOE) et de quatre universités a découvert que des changements subtils de l'environnement entourant certaines enzymes peuvent non seulement modifier la vitesse d'une réaction cellulaire de six ordres de grandeur, mais aussi sa direction. Cette inversion - la racine du dilemme du biais catalytique - est comme une vitesse dans une direction à 10 miles par seconde, puis en sens inverse à 1, 000, 000 milles par seconde. L'écart s'accumule rapidement.
"Selon le résultat souhaité, le biais pourrait être insurmontable ou l'une des meilleures choses qui soient jamais arrivées, " a déclaré Simone Raugei, un informaticien au PNNL et co-auteur de l'étude. "Une réaction peut avoir de nombreux intermédiaires et peut emprunter plusieurs voies, certaines plus efficaces que d'autres. Ainsi, être capable de régler l'environnement du catalyseur peut faire une différence remarquable dans la vitesse de réaction."
Les résultats, signalé dans le Journal de l'American Chemical Society , ont des implications importantes pour la conception de catalyseurs synthétiques utilisés dans les milieux industriels, où prédire et contrôler le comportement d'une réaction est critique. Les résultats fournissent également une meilleure compréhension fondamentale des facteurs qui contrôlent les processus métaboliques dans toute vie.
Biais catalytique dans les métalloenzymes
Dans la nature, le microbe Clostridium pasteurianum (Cp) produit plusieurs enzymes à base de fer, [FeFe]-hydrogénases, qui font partie d'un grand groupe de métalloenzymes. Les métalloenzymes sont impliquées dans une multitude de réactions qui remplissent de nombreuses fonctions, comme le déplacement de l'hydrogène à travers les communautés microbiennes, capter l'azote de l'air, produire du méthane, et la conversion des glucides.
La polyvalence rend les métalloenzymes, et les [FeFe]-hydrogénases spécifiquement, des sujets idéaux pour explorer les questions fondamentales liées aux transformations chimiques. En réalité, les hydrogénases ont été la source d'inspiration pour de nombreuses études sur l'électrocatalyse dans les réactions de conversion d'énergie financées par l'Office of Basic Energy Sciences du DOE, dit Morris Bullock, directeur du Centre d'électrocatalyse moléculaire, un centre de recherche DOE Energy Frontier.
"Les découvertes rapportées par différents groupes de recherche utilisant des approches complémentaires enrichissent notre compréhension des bases scientifiques fondamentales de la catalyse par les systèmes biologiques et moléculaires, " dit Bullock.
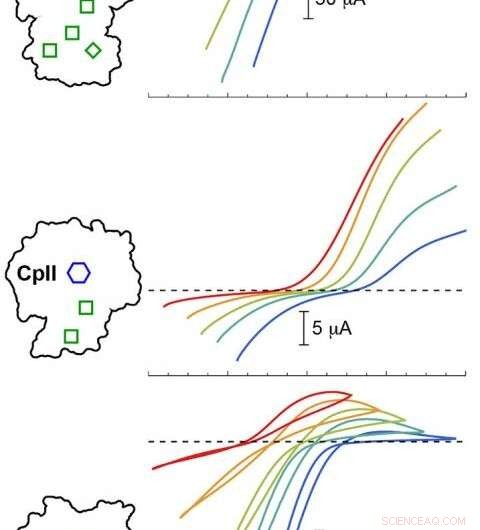
La modélisation informatique du PNNL a validé des expériences avec trois hydrogénases Cp à différentes valeurs de pH. Les résultats ont montré que le potentiel catalytique (courbes colorées) variait en fonction de la disposition du cluster H (hexagone bleu) et des clusters accessoires (boîtes vertes). Les traces colorées sous la ligne pointillée correspondent à la production d'hydrogène, tandis que les traces au-dessus de la ligne pointillée correspondent à l'oxydation de l'hydrogène. Crédit: Confiture. Chem. Soc . 2020, 142, 3, 1227-1235
John Peters, co-titulaire du PNNL, est professeur à la Washington State University (WSU) et directeur de Biological and Electron Transfer and Catalysis, un autre centre de recherche DOE Energy Frontier. Peters a commencé à étudier les [FeFe]-hydrogénases à la fin des années 1990 en utilisant des enzymes trouvées dans le microbe Cp. Mais ces études antérieures se sont concentrées sur les aspects mécanistiques généraux, et ce n'est que récemment que les chercheurs ont commencé à penser aux enzymes dans le contexte du biais catalytique.
Peters et Paul King, responsable du Groupe Biochimie Physique et Photosynthèse au Laboratoire National des Energies Renouvelables (NREL), co-conçu la nouvelle étude avec Raugei au PNNL et Anne Jones, professeur agrégé à la School of Molecular Sciences de l'Arizona State University (ASU).
L'étude visait à identifier comment trois [FeFe]-hydrogénases diffèrent dans le contrôle à la fois de la réduction des protons en hydrogène moléculaire, ainsi que la réaction inverse - l'oxydation de l'hydrogène moléculaire en protons. Chaque réaction dite redox joue un rôle critique dans le transfert d'énergie biologique et a été largement étudiée pour les applications de stockage et de production d'énergie.
Intermédiaires de réaction de réglage fin de l'électrostatique
L'étude de l'activité catalytique des trois hydrogénases [FeFe] a impliqué une puissante combinaison d'approches expérimentales dans de nombreuses installations de recherche et réalisée par des scientifiques de WSU, NREL et ASU. Raugei, également co-désignée à WSU, a dirigé l'équipe de modélisation théorique et computationnelle, dont le travail consistait à trier les observations expérimentales et à développer un modèle théorique du mécanisme enzymatique.
L'équipe de recherche a utilisé des mesures précises à partir de rayons X à l'installation de source de lumière cohérente Linac, situé à la source lumineuse de rayonnement synchrotron de Stanford, pour analyser la structure atomique de l'enzyme. Prochain, des chercheurs de l'ASU ont soumis l'enzyme à un courant électrique pour examiner l'activité électrocatalytique de chaque hydrogénase à la fois au repos et à l'état actif. Toutes les enzymes partageaient un cluster catalytique identique d'atomes de fer et de soufre, généralement appelé le cluster H, mais différaient par la composition de l'environnement protéique environnant.
Les chercheurs ont noté des différences significatives dans le biais de réaction entre les trois hydrogénases. Puis, lors des boucles de rétroaction entre les expériences et la modélisation informatique, des changements subtils dans le champ électrostatique autour du centre catalytique ont attiré l'attention de l'équipe.
« On a vu en effet que si le terrain était changé, nous avons pu conduire la réaction plus favorablement d'une manière ou d'une autre pour tenter d'expliquer l'observation expérimentale, " a déclaré Raugei. Les différences subtiles dans l'environnement, il a dit, déterminé la direction de la réaction dans des conditions d'état stable et affiné la vitesse de réaction.
Selon le roi, la stabilisation ou la déstabilisation sélective des intermédiaires catalytiques favorisait préférentiellement l'oxydation de l'hydrogène ou la réduction des protons. Spécifiquement, un environnement plus hydrophobe entourant le H-Cluster a réglé l'enzyme pour favoriser préférentiellement la production d'hydrogène, alors que l'oxydation de l'hydrogène était favorisée par un environnement moins hydrophobe.
"Ce travail, " dit le roi, « révèle la puissance de la biologie pour contrôler la réactivité des métalloenzymes pour répondre aux processus métaboliques uniques de toute vie et fournit de nouvelles informations précieuses pour la conception de plates-formes électrocatalytiques améliorées. »
Peters a déclaré que les caractéristiques de conception utilisées par les [FeFe]-hydrogénases pour régler et contrôler la réactivité sont probablement partagées par d'autres biocatalyseurs de sites métalliques. Les chercheurs prévoient d'affiner leur modèle pour fournir un schéma plus général permettant de comprendre le biais catalytique dans la classe plus large des enzymes redox et l'énergie métabolique qui anime toute vie.