Crédit :Dr Masahiro Yamashina
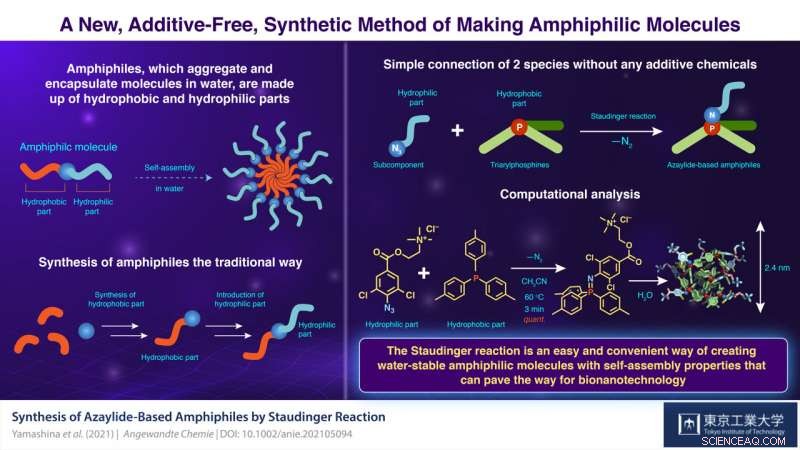
Molécules amphiphiles, qui agrègent et encapsulent des molécules dans l'eau, trouver une utilisation dans plusieurs domaines de la chimie. Le simple, la connexion sans additif de molécules hydrophiles et hydrophobes serait une méthode efficace pour la synthèse de molécules amphiphiles. Cependant, de telles connexions, ou des obligations, sont souvent fragiles dans l'eau. Maintenant, des scientifiques de l'Institut de technologie de Tokyo ont mis au point un moyen simple de préparer des amphiphiles stables dans l'eau par simple mélange. Leur nouvelle méthode sans catalyseur ni réactif aidera à créer d'autres matériaux fonctionnels.
Les savons et les détergents sont utilisés pour nettoyer des choses comme les vêtements et la vaisselle. Mais comment fonctionnent-ils réellement ? Il s'avère qu'ils sont constitués de longues molécules contenant une partie « hydrophile » ou hydrophile et une partie « hydrophobe » ou haïssant l'eau. Lorsqu'il est ajouté à l'eau, ces molécules s'auto-assemblent pour former des géantes, des « supramolécules » sphériques appelées micelles qui effectuent le nettoyage en utilisant la partie hydrophobe pour piéger la graisse.
Connus sous le nom d'« amphiphiles » des chimistes, ces molécules ont suscité beaucoup d'attention en raison de leur utilité dans le développement de matériaux supramoléculaires. La synthèse des amphiphiles nécessite généralement plusieurs réactions et purifications. En revanche, si les molécules hydrophiles et hydrophobes pouvaient être simplement connectées sans produits chimiques, ce serait une méthode synthétique très puissante. En réalité, certaines réactions ne nécessitant ni catalyseurs ni réactifs sont aujourd'hui connues. Cependant, ils ont un défaut fatal :leurs liaisons chimiques sont instables dans l'eau, le milieu même nécessaire à la formation des micelles !
Aborder cette question dans une étude récente publiée dans Angewandte Chemie , scientifiques de l'Institut de technologie de Tokyo (Tokyo Tech), Japon, dirigé par le Dr Masahiro Yamashina et le professeur Shinji Toyota, ont maintenant trouvé une solution en utilisant une réaction chimique connue sous le nom de "réaction de Staudinger, " dans lequel un azoture (partie hydrophile) et une phosphine (partie hydrophobe) se combinent pour former un "azaylide".
"Bien qu'une réaction typique de Staudinger se déroule rapidement et quantitativement à température ambiante, l'azaylide formé s'hydrolyse facilement en une amine primaire et un oxyde de phosphine dans l'eau. En revanche, une version "sans hydrolyse" de cette réaction a été récemment découverte, dans laquelle un atome d'halogène, comme le chlore, ajouté à un composé azoture améliore significativement l'hydrostabilité de l'azaylide, " explique Yamashina.
Par conséquent, l'équipe de scientifiques a préparé un sous-composant d'azoture chloré et l'a mélangé avec de la tris(p-tolyl)phosphine (PTol
L'équipe a également préparé les amphiphiles correspondants à base d'azaylide non chloré - nNPTol
Finalement, lorsqu'il est testé avec des colorants organiques hydrophobes comme Nile Red et BODIPY, l'équipe a vu que les molécules de colorant étaient encapsulées par les agrégats sphériques d'azaylide, présentant un comportement amphiphile souhaitable. "La formation d'azaylide présentée dans notre étude sert de technique viable pour la préparation sur site d'amphiphiles stables dans l'eau sans catalyseur ni réactif, qui peut aider à créer plus de tels matériaux fonctionnels à l'avenir, " dit Yamashina.