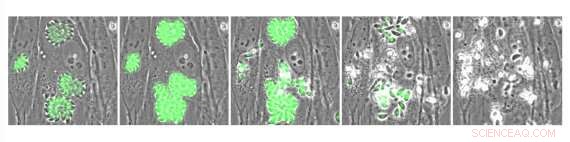
Parasites Toxoplasma intracellulaires exprimant l'indicateur de calcium GCaMP génétiquement codé. Les parasites ont été traités avec A23187, un composé qui provoque un afflux de calcium et stimule la sortie des parasites. Crédit :Whitehead Institute for Biomedical Research
Les parasites apicomplexes infectent chaque année des centaines de millions de personnes dans le monde. Plusieurs espèces de parasites apicomplexes du genre Plasmodium causent le paludisme, tandis qu'une autre espèce apicomplexe, Toxoplasma gondii (T. gondii), provoque la toxoplasmose, une maladie avec des symptômes pseudo-grippaux qui peuvent être mortelles pour les personnes dont le système immunitaire est affaibli. Malgré leur impact, la biologie de ces parasites pathogènes n'est pas très bien comprise et les options de traitement de l'infection sont limitées.
Une approche potentielle pour traiter l'infection pourrait être des médicaments qui perturbent la signalisation calcique des parasites, dont ils dépendent pour se propager de cellule en cellule chez leurs hôtes. Les parasites ont besoin d'un afflux de calcium pour sortir d'une cellule hôte infectée - un processus appelé sortie - et se déplacer dans le corps de l'hôte et envahir d'autres cellules. Dans des travaux antérieurs, un chercheur du laboratoire de Sebastian Lourido, membre du Whitehead Institute, Saïma Sidik, avait testé une grande collection de molécules et identifié une appelée activateur 1 (ENH1), qui a perturbé les niveaux de calcium des parasites et empêché la sortie, comme une piste antiparasitaire prometteuse. Cependant, les expériences originales n'ont pas déterminé comment ENH1 agit. Dans une recherche publiée dans la revue ACS Biologie Chimique le 29 juin, Alice Herneisen, un étudiant diplômé du laboratoire de Lourido, et Lourido, qui est également professeur adjoint de biologie au Massachusetts Institute of Technology, ont utilisé une approche appelée profilage du protéome thermique pour découvrir comment ENH1 empêche les parasites de T. gondii de sortir. Ils ont identifié la principale cible d'ENH1 comme une molécule dépendante du calcium appelée CDPK1 que les parasites utilisent pour se préparer à la sortie, se déplacer entre les cellules, et l'invasion des cellules hôtes. ENH1 se lie à CDPK1 et l'empêche de fonctionner.
« Les avancées des dernières décennies ont facilité la découverte de l'activité potentiellement thérapeutique d'une molécule, mais la prochaine étape pour comprendre comment fonctionne la molécule est souvent encore un défi, " dit Lourido. " En appliquant de nouvelles approches expansives, nous commençons à construire une image plus holistique de la biologie cellulaire des parasites."
Il est important de comprendre la biologie responsable des effets observés d'un médicament potentiel, car la plupart des médicaments doivent être modifiés avant d'être prêts à être utilisés par l'homme - il peut être nécessaire de les rendre moins toxiques, plus puissant, ou plus favorable à l'environnement du corps humain - et ces sortes de modifications ne peuvent pas être apportées tant que la molécule et son activité ne sont pas comprises.
Herneisen a décidé d'utiliser une approche relativement nouvelle chez les parasites, profilage du protéome thermique, découvrir les cibles de l'ENH1, les molécules auxquelles elle se lie, conduisant à ses effets thérapeutiques. L'approche fonctionne en représentant graphiquement comment chacune des protéines à l'intérieur du parasite réagit aux changements de chaleur avec et sans exposition à ENH1. L'un des avantages de cette approche est qu'elle est impartiale, ce qui signifie qu'au lieu que les chercheurs choisissent à l'avance des cibles probables à tester, ils étudient le plus de molécules possible, ce qui peut conduire à des résultats inattendus. Par exemple, Lourido étudie CDPK1 dans d'autres contextes depuis de nombreuses années, et sur la base de la compréhension antérieure de son laboratoire de son rôle, il ne s'attendait pas à ce qu'il soit une cible principale d'ENH1 - de telles surprises peuvent orienter la recherche dans de nouvelles directions passionnantes.
Bien que CDPK1 soit la cible principale d'ENH1, les investigations n'ont pas découvert la cible qui permet à ENH1 de provoquer des oscillations dans les niveaux de calcium des parasites. Trouver cette cible manquante est l'un des prochains objectifs du laboratoire.
"Le fait que ENH1 affecte de multiples aspects de la signalisation calcique peut être ce qui en fait un agent antiparasitaire si efficace, " dit Herneisen. " C'est jouer avec les parasites à plusieurs niveaux. "
La traduction de la recherche pour les essais cliniques est loin, mais il y a plusieurs indicateurs qu'il s'agit d'une direction prometteuse pour l'enquête. Non seulement la signalisation du calcium est-elle la clé du cycle de vie des parasites et de leur capacité à se propager à l'intérieur d'un hôte, mais les molécules et les mécanismes que les parasites utilisent pour moduler les niveaux de calcium sont très différents de ceux trouvés chez les mammifères. Cela signifie qu'un médicament qui perturbe la signalisation calcique des parasites est peu susceptible d'interférer avec la signalisation calcique chez les patients humains, et pourrait donc être mortelle pour les parasites sans endommager les cellules des patients.