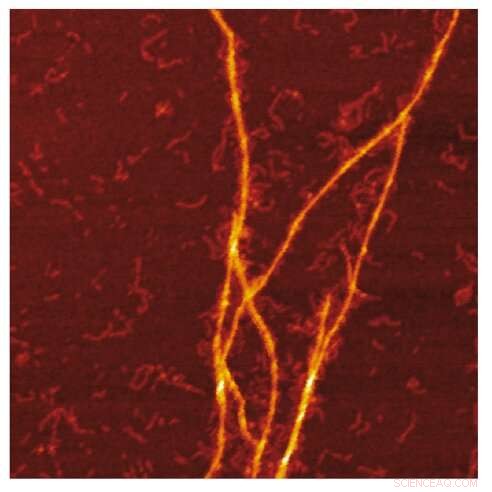
Image AFM de la modélisation amyloïde des fibrilles S100A9 à la surface des fibrilles Aβ. Crédit :Jonathan Pansieri
Une équipe de recherche dirigée par Ludmilla Morozova Roche à l'Université d'Umeå, Suède, a fourni un aperçu mécanistique de la co-agrégation des protéines dans la maladie d'Alzheimer. Le mécanisme de modélisation des amyloïdes S100A9 sur les surfaces fibrillaires Aβ au cours du processus de co-agrégation a été révélé par la synergie de méthodes biophysiques, notamment la spectrométrie de masse à détection de charge, microscopie, analyses cinétiques et microfluidiques.
La formation d'amyloïde est d'une importance clinique clé puisque ce processus est impliqué dans de nombreuses maladies neurodégénératives telles que la maladie d'Alzheimer, Parkinson et autres. Ces maladies affectent des millions de personnes vieillissantes dans le monde. Il est souvent difficile de tracer la ligne entre ces maladies ou elles peuvent survenir simultanément, connue sous le nom de comorbidité de la maladie.
Alors que le processus de formation de l'amyloïde a été largement étudié, on sait peu de choses sur les mécanismes spécifiques de co-agrégation de différentes espèces amyloïdes ensemble, sous-tendant la comorbidité des maladies. Dans la maladie d'Alzheimer, la cascade amyloïde-neuro-inflammatoire se manifeste par la co-agrégation d'Aβ avec la protéine pro-inflammatoire S100A9, ce qui conduit à l'assemblage amyloïde intracellulaire et extracellulaire, dépôts de plaque amyloïde et toxicité cellulaire.
Décrypter les interactions entre la protéine pro-inflammatoire S100A9 et le peptide Aβ42 dans la maladie d'Alzheimer est fondamental puisque l'inflammation joue un rôle central dans l'apparition de la maladie. Ici, les chercheurs utilisent la spectrométrie de masse à détection de charge (CDMS) innovante ainsi que des techniques biophysiques pour fournir un aperçu mécanistique du processus de co-agrégation et différencier les complexes amyloïdes à un niveau de particule unique.
La combinaison des distributions de masse et de charge des amyloïdes ainsi que la reconstruction des différences entre elles et la microscopie détaillée révèlent que la co-agrégation implique la création de modèles de fibrilles S100A9 à la surface des amyloïdes Aβ42. L'analyse cinétique corrobore en outre que les surfaces disponibles pour la nucléation secondaire Aβ42 sont diminuées en raison du revêtement par les amyloïdes S100A9, tandis que la liaison de S100A9 aux fibrilles Aβ42 est validée par un dosage microfuidique.
Les chercheurs démontrent que la synergie entre CDMS, microscopie, les analyses cinétiques et microfuidiques ouvrent de nouvelles voies dans la recherche interdisciplinaire.