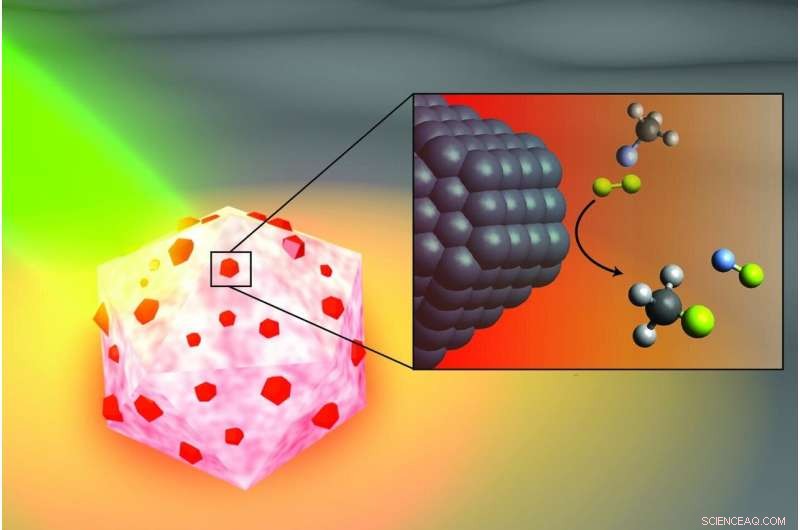
Illustration d'un artiste du catalyseur d'antenne-réacteur activé par la lumière Les ingénieurs de l'Université Rice ont conçu pour briser les liaisons carbone-fluor dans les fluorocarbures. La partie aluminium de la particule (blanche et rose) capte l'énergie de la lumière (verte), activation des îlots de catalyseurs au palladium (rouge). Dans l'encart, molécules de fluorométhane (en haut) composées d'un atome de carbone (noir), trois atomes d'hydrogène (gris) et un atome de fluor (bleu clair) réagissent avec les molécules de deutérium (jaune) près de la surface du palladium (noir), clivage de la liaison carbone-fluor pour produire du fluorure de deutérium (à droite) et du méthane monodeutéré (en bas). Crédit :H. Robatjazi/Rice University
Les ingénieurs de l'Université Rice ont créé un catalyseur alimenté par la lumière qui peut briser les fortes liaisons chimiques dans les fluorocarbures, un groupe de matériaux synthétiques qui comprend des polluants environnementaux persistants.
Dans une étude publiée ce mois-ci dans Catalyse naturelle , La pionnière de la nanophotonique du riz Naomi Halas et ses collaborateurs de l'Université de Californie, Santa Barbara (UCSB) et l'Université de Princeton ont montré que de minuscules sphères d'aluminium parsemées de grains de palladium pouvaient rompre les liaisons carbone-fluor (C-F) via un processus catalytique connu sous le nom d'hydrodéfluoration dans lequel un atome de fluor est remplacé par un atome d'hydrogène.
La force et la stabilité des liaisons C-F sont à l'origine de certaines des marques chimiques les plus reconnaissables du 20e siècle, y compris le téflon, Fréon et Scotchgard. Mais la force de ces liaisons peut être problématique lorsque des fluorocarbures pénètrent dans l'air, sol et eau. Chlorofluorocarbures, ou CFC, par exemple, ont été interdits par un traité international dans les années 1980 après avoir découvert qu'ils détruisaient la couche d'ozone protectrice de la Terre, et d'autres fluorocarbures figuraient sur la liste des « produits chimiques pour toujours » visés par un traité de 2001.
« La partie la plus difficile de l'assainissement de l'un des composés contenant du fluor est de rompre la liaison C-F ; cela nécessite beaucoup d'énergie, " dit Halas, un ingénieur et chimiste dont le Laboratoire de nanophotonique (LANP) est spécialisé dans la création et l'étude de nanoparticules qui interagissent avec la lumière.
Au cours des cinq dernières années, Halas et ses collègues ont mis au point des méthodes de fabrication de catalyseurs "antenne-réacteur" qui stimulent ou accélèrent les réactions chimiques. Alors que les catalyseurs sont largement utilisés dans l'industrie, ils sont généralement utilisés dans des processus énergivores qui nécessitent une température élevée, haute pression ou les deux. Par exemple, une maille de matériau catalytique est insérée dans un récipient à haute pression dans une usine chimique, et le gaz naturel ou un autre combustible fossile est brûlé pour chauffer le gaz ou le liquide qui s'écoule à travers la maille. Les antennes-réacteurs de LANP améliorent considérablement l'efficacité énergétique en capturant l'énergie lumineuse et en l'insérant directement au point de la réaction catalytique.
Dans le Catalyse naturelle étudier, l'antenne de capture d'énergie est une particule d'aluminium plus petite qu'une cellule vivante, et les réacteurs sont des îlots de palladium dispersés sur la surface de l'aluminium. La caractéristique d'économie d'énergie des catalyseurs d'antenne-réacteur est peut-être mieux illustrée par un autre succès antérieur de Halas :la vapeur solaire. En 2012, son équipe a montré que ses particules de récolte d'énergie pouvaient vaporiser instantanément des molécules d'eau près de leur surface, ce qui signifie que Halas et ses collègues pouvaient faire de la vapeur sans faire bouillir d'eau. Pour enfoncer le clou, ils ont montré qu'ils pouvaient faire de la vapeur à partir d'eau glacée.
La conception du catalyseur antenne-réacteur permet à l'équipe de Halas de mélanger et assortir les métaux les mieux adaptés pour capturer la lumière et catalyser les réactions dans un contexte particulier. Le travail fait partie du mouvement de la chimie verte vers plus propre, des procédés chimiques plus efficaces, et LANP a déjà fait la démonstration de catalyseurs pour produire de l'éthylène et du gaz de synthèse et pour séparer l'ammoniac pour produire de l'hydrogène combustible.
L'auteur principal de l'étude Hossein Robatjazi, un boursier postdoctoral Beckman à l'UCSB qui a obtenu son doctorat. de Riz en 2019, a mené la majeure partie de la recherche au cours de ses études supérieures dans le laboratoire de Halas. Il a déclaré que le projet montre également l'importance de la collaboration interdisciplinaire.
"J'ai terminé les expériences l'année dernière, mais nos résultats expérimentaux avaient des caractéristiques intéressantes, modifications de la cinétique de réaction sous éclairage, cela a soulevé une question importante mais intéressante :quel rôle joue la lumière pour promouvoir la chimie de rupture C-F ?", a-t-il déclaré.
Les réponses sont venues après l'arrivée de Robatjazi pour son expérience postdoctorale à l'UCSB. Il a été chargé de développer un modèle de microcinétique, et une combinaison d'informations du modèle et de calculs théoriques effectués par des collaborateurs de Princeton a aidé à expliquer les résultats déroutants.
"Avec ce modèle, nous avons utilisé la perspective de la science des surfaces dans la catalyse traditionnelle pour lier de manière unique les résultats expérimentaux aux changements de la voie de réaction et de la réactivité sous la lumière, " il a dit.
Les expériences de démonstration sur le fluorométhane pourraient n'être qu'un début pour le catalyseur de rupture C-F.
"Cette réaction générale peut être utile pour remédier à de nombreux autres types de molécules fluorées, " dit Halas.