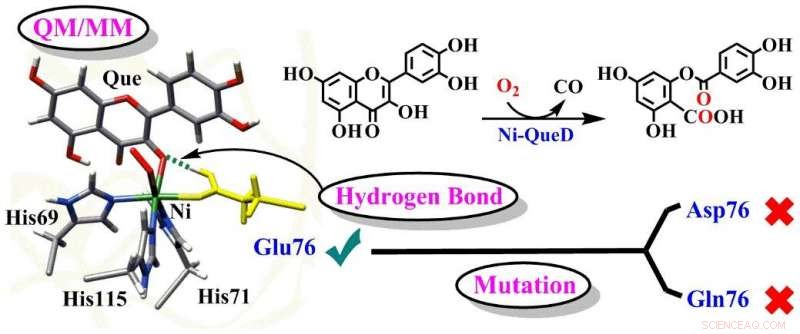
Illustration schématique des rôles cruciaux du résidu Glu76 dans Ni-QueD. Crédit :Groupe du Pr LI
L'activation catalytique du dioxygène et le clivage oxydatif sélectif des liaisons C-C sont devenus les points chauds de la recherche dans le domaine de la chimie en raison de leur grande valeur d'application dans la synthèse organique et la production industrielle.
Quercétine 2, 4-dioxygénases (QueDs), en tant que système biologique typique de métalloenzyme, peut activer efficacement le dioxygène et catalyser sélectivement le clivage oxydatif des liaisons C-C des substrats organiques de flavonol dans des conditions douces. Bien que des études sur les QueD soient menées depuis des décennies, les mécanismes catalytiques détaillés des QueDs, en particulier les rôles du résidu Glu76 au site actif, sont encore en débat.
Dans une étude publiée dans le Journal de Catalyse , un groupe dirigé par le professeur LI Chunsen du Fujian Institute of Research on the Structure of Matter (FJIRSM) de l'Académie chinoise des sciences a rapporté les mécanismes détaillés des réactions catalysées par la quercétine 2 dépendante du nickel de type sauvage, 4-dioxygénase (Ni-QueD) et ses mutants Glu76Asp et Glu76Gln en utilisant des simulations MD combinées et des calculs QM/MM, et ils ont révélé le rôle critique du résidu Glu76 dans le pilotage de la réactivité de Ni-QueD.
Les chercheurs ont découvert que le résidu Glu76 de ligature du nickel conservé sous la forme déprotonée est essentiel pour initier la réaction catalytique par le processus de transfert d'électrons couplé au proton.
Le Glu76 généré et protoné favorise la réaction ultérieure en régulant l'interaction de liaison hydrogène (liaison H) avec les groupes carbonyle de la quercétine.
Les recherches sur les mutants Glu76Gln et Glu76Asp montrent que la mutation de Glu76 supprime une telle interaction de liaison H et entraîne une activité catalytique plus faible observée expérimentalement.
Cette étude fournit non seulement des informations utiles sur les mécanismes des réactions catalysées par les QueDs dépendant des ions métalliques, mais aussi des informations sur la façon dont les enzymes réalisent des réactions spécifiques en utilisant l'interaction de liaison H à partir des résidus de ligature du centre métallique.