Crédit: Sciences chimiques (2020). DOI :10.1039/D0SC01935F
Une équipe de recherche de l'Université d'Uppsala a ressuscité des enzymes vieilles de plusieurs milliards d'années et les a reprogrammées pour catalyser des réactions chimiques complètement différentes de celles que leurs versions modernes peuvent gérer. La méthode peut être utilisée pour développer des solutions durables au sein de la biotechnologie, comme pour les bioréacteurs enzymatiques ou pour dégrader chimiquement les toxines environnementales. L'étude a été publiée dans Sciences chimiques .
"Nous utilisons des logiciels pour simuler des milliards d'années d'évolution, et nous avons pu développer une enzyme efficace qui peut catalyser une réaction complètement nouvelle. C'est incroyablement excitant, " dit Lynn Kamerlin, qui dirige l'équipe de recherche de l'Université d'Uppsala.
Les enzymes ont la capacité de catalyser, c'est-à-dire accélérer, défiant des réactions chimiques de millions d'années à une fraction de seconde sans être eux-mêmes consommés. Ils sont également biodégradables et ont une empreinte carbone minimale. La plupart des enzymes sont des catalyseurs pour une réaction chimique spécifique, qui remplit une fonction importante dans les processus biologiques, par exemple dans notre corps.
Au sein de la biotechnologie, un travail intensif est en cours pour développer de nouvelles enzymes capables de catalyser des réactions inhabituelles pour la chimie verte, la catalyse durable et la décomposition chimique des substances toxiques pour l'environnement.
L'équipe de recherche de l'Université d'Uppsala a travaillé avec des collègues de l'Université de Grenade en Espagne pour ressusciter les enzymes ancestrales, d'abord sur un ordinateur, puis en laboratoire. Les enzymes primitives ont de nombreuses caractéristiques qui sont souhaitables en biotechnologie. Ils peuvent résister à des températures extrêmes et ils sont structurellement plus flexibles, les rendant plus faciles à modifier que leurs équivalents modernes.
Les chercheurs ont réussi à réutiliser d'anciennes enzymes dégradant les antibiotiques pour catalyser une toute nouvelle réaction non naturelle. Mais même si les enzymes réutilisées ont considérablement accéléré la réaction, il était beaucoup plus lent que la plupart des enzymes naturelles.
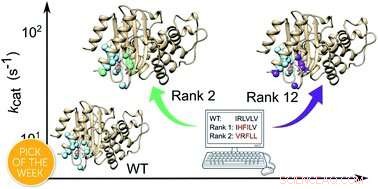
Par conséquent, pour améliorer l'efficacité de l'enzyme, les chercheurs ont utilisé des ordinateurs puissants pour calculer quels changements dans la structure entraîneraient une réaction plus rapide. Ils ont utilisé une nouvelle méthode appelée FuncLib, qui utilise une combinaison d'informations évolutives et de calculs de stabilité des protéines, pour prédire des variantes enzymatiques plus efficaces.
Un total de 3, 000 nouvelles variantes enzymatiques potentielles ont été prédites par FuncLib et les 20 plus prometteuses d'entre elles ont été testées en laboratoire. Parmi ceux-ci, quatre étaient beaucoup plus rapides que l'enzyme d'origine. Le meilleur était aussi efficace que la moyenne moderne, enzymes naturelles.
« Notre étude montre qu'il est possible de concevoir de nouveaux, des enzymes efficaces pour un avenir plus durable, " dit Lynn Kamerlin.