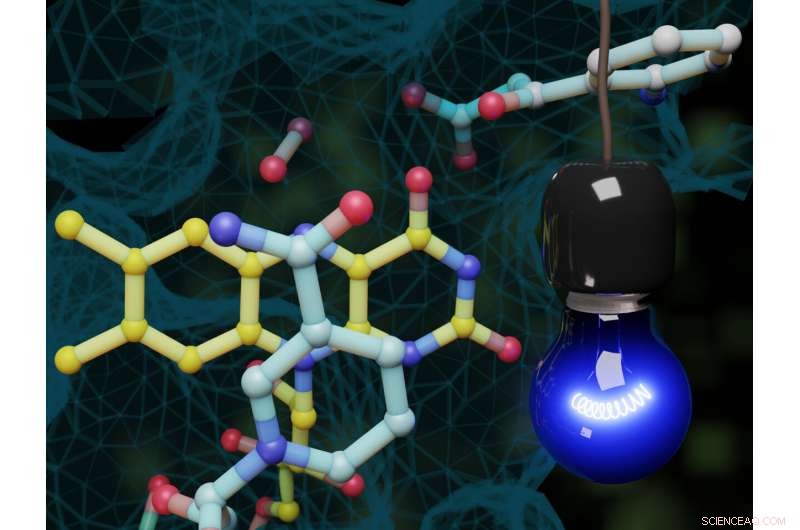
Dans le modèle :la lumière bleue déclenche une réaction spéciale de monooxygénase dans une enzyme. Ce type d'activation était jusqu'alors inconnu en enzymologie. Crédit :Steffen L. Drees
Les enzymes sont les moteurs centraux des processus métaboliques biochimiques dans chaque cellule vivante, permettant aux réactions de se dérouler efficacement. C'est cette capacité qui les rend utiles comme catalyseurs en biotechnologie, par exemple, pour créer des produits chimiques tels que des produits pharmaceutiques. Un sujet actuellement largement débattu est la catalyse photo-induite, dans lequel les chercheurs exploitent la capacité de déclencher des réactions biochimiques à l'aide de la lumière. Ce processus nécessite des enzymes qui peuvent être activées au moyen de la lumière. Ce n'est pas, cependant, une simple question d'incorporer les quelques enzymes naturellement activables par la lumière dans des processus biotechnologiques, car ils sont hautement spécialisés et difficiles à manipuler.
Des chercheurs des universités de Münster (Allemagne) et de Pavie (Italie) viennent d'identifier une enzyme qui devient catalytiquement active lorsqu'elle est exposée à la lumière bleue et qui déclenche immédiatement une réaction jusqu'alors inconnue en enzymologie. La réaction en question est une réaction spéciale de monooxygénase, dans lequel un atome d'oxygène est transféré au substrat. La réaction est soutenue par une molécule auxiliaire qui délivre deux électrons par étapes. Précédemment, on avait supposé qu'une telle réaction dépendante de la lumière ne pouvait pas se produire dans les enzymes.
"L'enzyme que nous avons identifiée appartient à une très grande famille d'enzymes, et il est réaliste de supposer que d'autres enzymes qui peuvent être activées par la lumière peuvent être produites au moyen de manipulations génétiques et utilisées dans une très large gamme d'applications, " dit le Dr Steffen L. Drees, qui a dirigé l'étude et travaille à l'Institut de microbiologie moléculaire et de biotechnologie de l'Université de Münster. Une application possible, par exemple, est la production de produits pharmaceutiques activée au moyen de la lumière. L'étude a été publiée dans la revue Communication Nature .
Dans leur étude, les chercheurs ont étudié l'enzyme PqsL, qui se trouve dans le pathogène opportuniste Pseudomonas aeruginosa et, à l'origine n'était pas dépendant de la lumière. Les chercheurs ont stimulé l'enzyme avec de la lumière bleue et analysé la réaction en utilisant une combinaison de techniques spectroscopiques et cristallographiques résolues en temps.
L'enzyme appartient à la famille des flavoprotéines, et typiquement pour cette famille de protéines, utilise un dérivé de la vitamine B2 comme cofacteur pour catalyser l'incorporation d'oxygène dans les molécules organiques. Le cosubstrat NADH (réduit nicotinamide adénine dinucléotide) est nécessaire comme "molécule auxiliaire" pour la réaction enzymatique, fournir les électrons nécessaires. Le mécanisme de réaction observé par les chercheurs dans leur étude était auparavant inconnu. Activé par l'exposition à la lumière dans le complexe flavine-NADH, Le NADH transfère un seul électron à la flavine liée aux protéines. De cette façon, un radical flavine est créé - il s'agit d'une molécule hautement réactive caractérisée par un électron non apparié. En utilisant la spectroscopie résolue en temps, les chercheurs ont pu observer comment la molécule s'est formée et a changé d'état.
Le radical flavine a un potentiel redox très négatif, ce qui signifie qu'il a une grande capacité de transfert d'électrons aux partenaires de réaction. « En raison de cette propriété, on suppose que le radical flavine peut aussi permettre des réactions supplémentaires, ce qui augmenterait le potentiel catalytique de cette enzyme - ainsi que d'autres enzymes aussi, peut-être, ", déclare la chef de groupe, la professeure Susanne Fetzner.
L'enzyme identifiée est la seule à ce jour qui n'est pas naturellement photoactive, et effectue une réaction indépendante de la lumière dans la cellule bactérienne. "La structure tridimensionnelle de l'enzyme montre que le cofacteur flavine tourné vers l'extérieur pourrait être la clé de la photoactivation, " dit Simon Ernst, premier auteur de l'étude.
Les enzymes photoactives permettent un grand nombre d'applications, par exemple, catalyse multi-étapes dans une réaction à un récipient ou catalyse spatialement résolue, par exemple, pour fonctionnaliser les surfaces selon certains motifs. Ils peuvent également être utiles pour l'activation dite de promédicament dans le corps ou sur la peau - il s'agit d'un processus dans lequel une substance pharmacologique ne devient active qu'après métabolisation dans l'organisme.