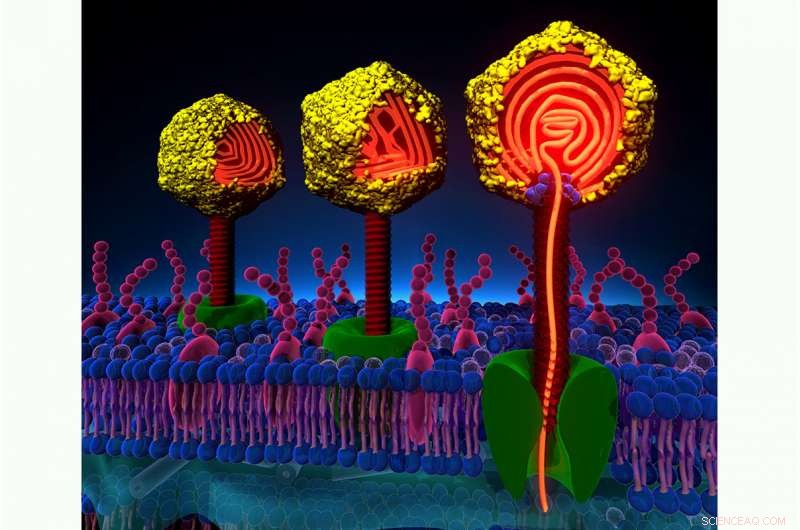
Les virus peuvent injecter leur ADN dans une cellule hôte de manière synchrone ou aléatoire, une nouvelle étude trouve. La différence semble influencer l'évolution de l'infection. Crédit :Alex Evilevitch et Ting Liu
Une nouvelle étude révèle un mécanisme jusqu'alors inconnu qui détermine si les virus qui infectent les bactéries vont rapidement tuer leurs hôtes ou rester latents à l'intérieur de la cellule. La découverte, rapporté dans la revue eLife, peut également s'appliquer aux virus qui infectent les humains et d'autres animaux, dit le chercheur.
"J'ai découvert pour la première fois que les mécanismes de conditionnement de l'ADN à l'intérieur d'un virus déterminent le cours de l'infection, " a déclaré Alex Evilevitch, professeur de pathobiologie à l'Université de l'Illinois, qui a mené l'étude.
Après avoir injecté leur ADN dans une cellule, les virus ont tendance à suivre l'une des deux principales voies, infections dites « lytiques » ou « latentes ». Dans la voie lytique, L'ADN viral réquisitionne rapidement les propres ressources de la cellule hôte pour faire des centaines de copies d'elle-même. Les nouveaux virus tuent alors la cellule et continuent à répéter le cycle dans d'autres cellules.
Les infections virales latentes suivent un cours différent, cependant :Une fois à l'intérieur de la cellule, l'ADN viral s'incorpore dans le génome de l'hôte. Lorsque la cellule se divise, l'ADN viral est également dupliqué. Tant que l'infection reste latente, il y a peu de preuves de cela dans l'hôte.
Le problème avec les infections virales latentes est que, en période de stress pour l'hôte, le virus peut soudainement devenir lytique, s'emparer de la cellule et la tuer après une folle période de reproduction, dit Evilévitch.
« Les nombreuses infections virales que nous portons peuvent rester latentes pendant très longtemps. Parfois, elles deviennent lytiques, et c'est à ce moment que nous développons des symptômes, " il a dit.
Les infections virales latentes chez l'homme comprennent l'herpès simplex, varicelle-zona, Epstein-Barr, cytomégalovirus humain, adénovirus, le sarcome de Kaposi et plusieurs autres.
"Il est très important de savoir ce qui régule le passage de l'état latent à l'état lytique, afin que nous puissions peut-être empêcher ces infections de se propager, " dit Evilévitch.
De nombreuses études sur la dynamique de l'infection virale se sont concentrées sur les caractéristiques structurelles des capsides protéiques qui protègent le matériel génétique viral et le transportent vers le site de l'infection. Evilevitch a plutôt examiné les contraintes et les contraintes sur les molécules d'ADN viral juste avant qu'elles ne soient injectées dans un hôte.
Il a utilisé la calorimétrie de titrage isotherme, qui peut mesurer des changements discrets d'énergie thermique dans un système, pour suivre l'évolution de l'infection. Dans une étude précédente, son groupe de laboratoire a découvert que le processus d'infection virale dégage de la chaleur. Dans la nouvelle étude, Evilevitch a exposé la bactérie hôte, Escherichia coli, à des milliers de particules virales, puis surveillé les hauts et les bas thermiques qui se sont produits au fur et à mesure que l'infection progressait.
Il a découvert que les infections se produisaient soit de manière synchrone – avec des centaines de virus injectant leur ADN dans la bactérie en même temps – soit de manière aléatoire, les infections se produisant plus lentement et de manière non coordonnée. Un examen plus approfondi du matériel génétique viral avant l'infection a révélé que l'ADN emballé à l'intérieur du virus avait tendance à être plus "liquide" dans les infections synchrones mais plus rigide pendant les infections aléatoires.
Les infections synchrones correspondaient étroitement aux infections latentes qui préservaient l'hôte, tandis que le plus lent, un processus d'infection plus aléatoire a conduit à des événements lytiques qui ont tué l'hôte.
Au fur et à mesure que la température augmentait, l'ADN viral est devenu plus liquide et les infections étaient plus susceptibles d'être synchrones. Les augmentations des concentrations d'ions magnésium extracellulaires liées au métabolisme cellulaire et aux conditions de croissance ont également favorisé des infections synchrones, Evilévitch retrouvé.
La chaleur a rendu les molécules d'ADN à l'intérieur de la capside plus flexibles, réduire le frottement de glissement entre eux, il a dit. L'ajout d'ions chargés positivement a réduit la répulsion entre les molécules d'ADN chargées négativement, rendant également l'ADN plus fluide.
"L'ADN devient plus flexible, il a un caractère plus fluide, " dit-il. " En conséquence, il est plus susceptible d'être éjecté – comme du dentifrice hors d'un tube. Mais si c'est solide, il va se coincer à l'intérieur du tube."
Les nouvelles découvertes sont "bonnes pour la virologie, " dit Evilévitch.
"Nous comprenons maintenant que la mécanique de l'ADN emballé à l'intérieur du virus influence directement la direction de l'infection vers une voie lytique ou latente, " a-t-il dit. " Nous pensons que cela nous aidera à apprendre comment contrôler les infections et les empêcher de devenir lytiques. Cela peut potentiellement conduire à de nouvelles thérapies pour empêcher la propagation de l'infection. »