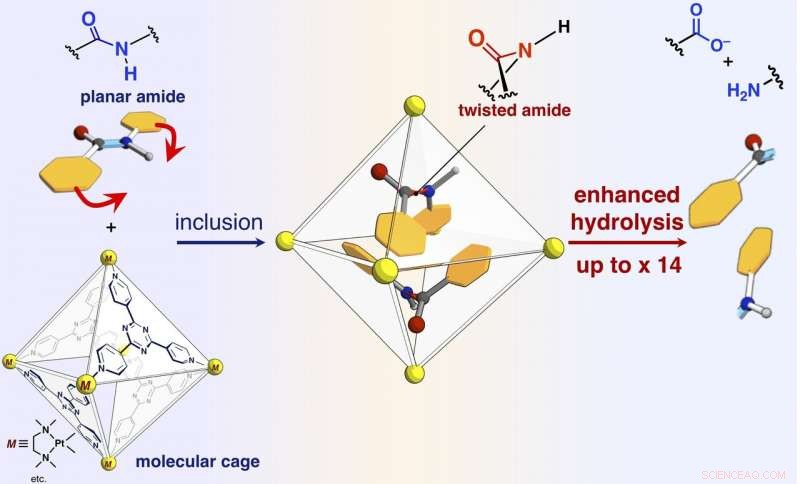
Un schéma d'accélération de la vitesse de réaction de l'hydrolyse des amides par inclusion dans la cage moléculaire auto-assemblée. Crédit :NINS/IMS
Les protéines sont composées d'acides aminés reliés par des liaisons amides. La liaison amide présente une stabilité chimique élevée et a une structure plane autour de la liaison. Bien que la grande stabilité de la liaison amide soit indispensable au maintien des fonctions des protéines, il est problématique de convertir le bloc de construction en une autre espèce moléculaire par dissociation sélective d'une liaison amide pertinente.
Il y a eu des tentatives pour contrôler la réactivité d'une liaison amide spécifique via une torsion sélective par des modifications chimiques compliquées. Certains composés modèles avec des liaisons amides torsadées ont été produits par synthèse organique en plusieurs étapes, et leur grande réactivité a été démontrée. On suppose que la réactivité élevée de ces liaisons amides torsadées est également utilisée in vivo. Certaines protéines semblent être sélectivement clivées en tordant des liaisons amides spécifiques pendant l'autolyse et l'épissage. Ces protéines, contrairement aux composés modèles synthétisés artificiellement, sont censés utiliser des interactions non covalentes pour tordre leurs liaisons amides. Pendant de nombreuses années, des chercheurs de l'Université de Tokyo et de l'Institute for Molecular Science ont fabriqué des cages moléculaires auto-assemblées par des interactions non covalentes. Ils ont appliqué leurs cages moléculaires pour confiner les molécules d'amide, qui peuvent être considérés comme des analogues de petits morceaux de protéines, et pressé les liaisons amide en les pressurisant à l'intérieur de leur cage.
Les chercheurs ont rapporté dans le présent article que les liaisons amide, qui ont des structures planes et sont inertes dans l'espace libre, peut être tordu, et les composés amides peuvent être activés en les confinant dans leur cage moléculaire (montrée sur la figure). Lorsque les composés amides cibles et la cage moléculaire sont mélangés et chauffés dans une solution aqueuse, la cage confine les composés amidés. L'analyse de la structure aux rayons X d'un monocristal a révélé que deux composés amides avec des structures torsadées sont confinés dans la cage. L'angle de torsion autour des liaisons amide atteignait 34 degrés. La vitesse de réaction d'hydrolyse de la cible torsadée a été accélérée d'un facteur cinq. Les chercheurs ont réussi à créer une nouvelle enzyme artificielle d'un mécanisme auparavant inexploité qui confine et tord les molécules cibles pour activer une liaison chimique spécifique.
Les chercheurs ont également réussi à altérer la réactivité de molécules cibles en confinant « des molécules de bourrage, " qui n'interviennent pas dans la réaction, avec les cibles dans la cage, contrôlant ainsi précisément le degré de torsion des liaisons amide. Sans la molécule de rembourrage, les deux amides cibles sont confinés dans une cage. L'une des deux cibles est tordue et l'autre reste plane. En revanche, lorsque la farce conique est mélangée puis impliquée avec la cible dans une cage, la cible reste plane. Lorsqu'une molécule de remplissage planaire est impliquée avec la cible, le rembourrage change la forme de la cible en une structure tordue. Les chercheurs ont étudié les taux de réaction d'hydrolyse dans les deux cas et ont constaté que le rembourrage planaire (cible tordue) accélère le taux de 14 fois, tandis que le bourrage conique (cible planaire) a accéléré le rythme de trois fois. Les molécules de rembourrage permettent aux chercheurs d'ajuster précisément la vitesse de réaction. Il s'agit d'une réalisation sans précédent qui n'a jamais été trouvée dans les études précédentes. Cette recherche offre une nouvelle méthode pour l'activation de molécules inertes et peut être appliquée à une variété de réactions organiques.
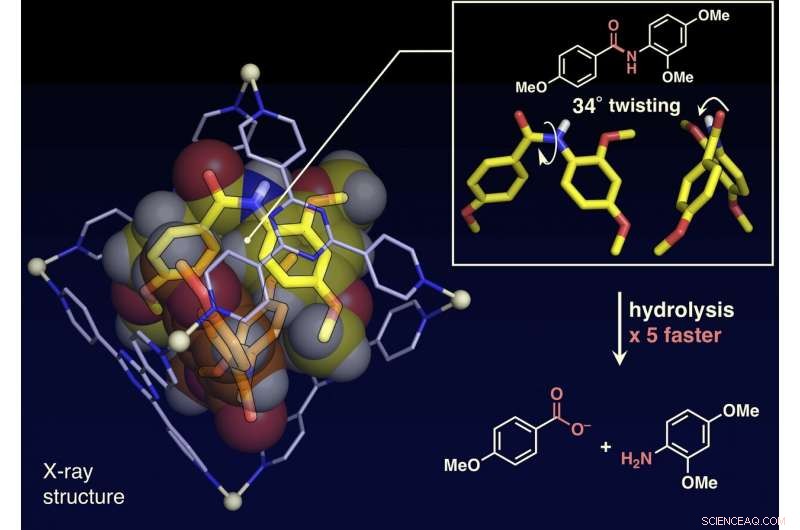
L'analyse de la structure monocristalline a montré que les molécules d'amide planaires étaient tordues jusqu'à 34 degrés à l'intérieur de la cage. La vitesse d'hydrolyse par une base a été accélérée d'un facteur cinq. Crédit :NINS/IMS
Les chercheurs ont montré que les molécules d'amide peuvent être activées par torsion à l'intérieur de la cage sans processus de modification chimique fastidieux. « Nous recherchons un nouveau type de cage capable d'activer les cibles avec une plus grande efficacité et de les appliquer à d'autres catégories de molécules cibles. Avec nos nouvelles cages, nous développerons la nouvelle méthode d'activation de molécules inertes. À l'avenir, nos cages serviront de catalyseurs, qui pressent et activent sélectivement une liaison spécifique d'une molécule cible et également en tant qu'agents d'activation pour les promédicaments agissant dans le corps, " dit Fujita.
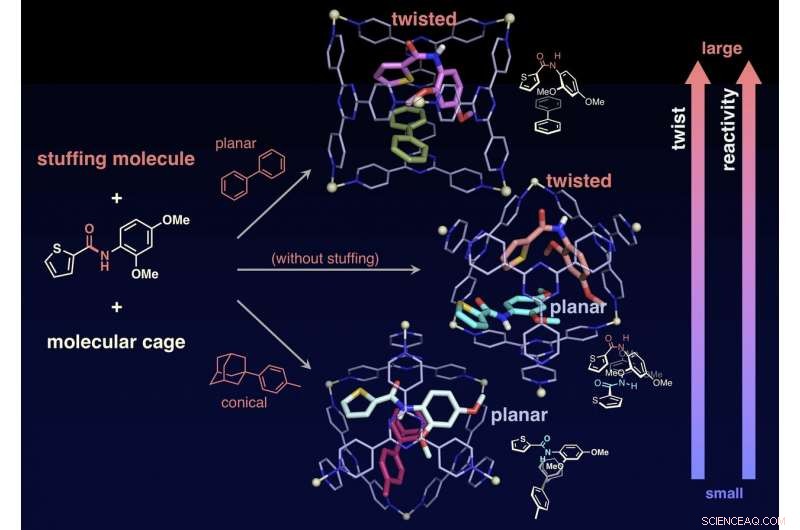
L'angle de torsion, puis la réactivité à l'hydrolyse, peut être contrôlé en confinant la molécule de rembourrage avec l'amide cible dans la cage. Crédit :NINS/IMS