Crédit :Université RUDN
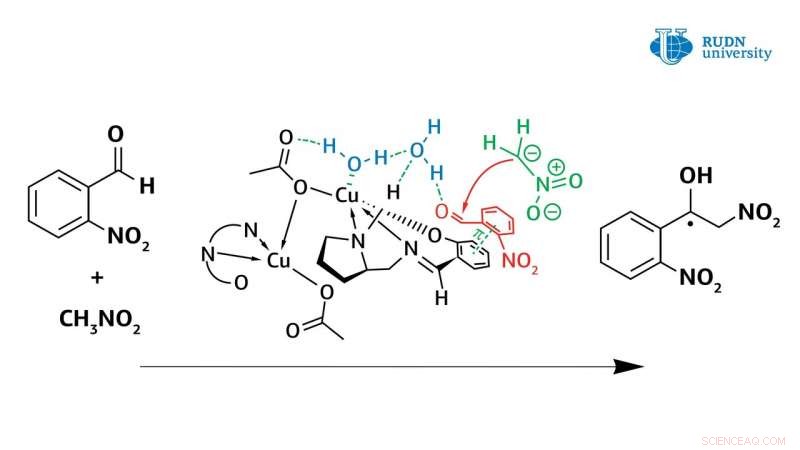
Un chimiste de l'Université RUDN a révisé le mécanisme de la réaction de Henry catalysée par des complexes de cuivre(II). Ainsi, en utilisant de nouveaux complexes de cuivre(II) obtenus dans le même laboratoire, il a montré que l'eau joue un rôle crucial dans la réaction asymétrique de Henry, participent directement au cycle catalytique de la réaction. Précédemment, ce facteur n'a jamais été pris en compte, et les scientifiques pensaient que le complexe de cuivre (II) fonctionne comme un acide de Lewis classique.
En réalité, le complexe de cuivre en coordination avec la molécule d'eau l'active, le transformer en acide de Bronsted, Et ainsi, l'eau active l'aldéhyde d'origine. Les données obtenues à partir de l'expérience permettent aux chercheurs de comprendre le mécanisme de la réaction de Henry et aideront à la création des classes de substances les plus importantes pour l'industrie pharmaceutique :les α-nitrocétones, cétones, les nitroalcènes et les -aminoalcools. Les résultats sont publiés dans la revue internationale américaine Chimie inorganique .
La réaction asymétrique de Henry, permettant la synthèse de molécules organiques de valeur, a été menée pour la première fois par le chimiste japonais Masakatsu Shibasaki en 1992. Il a pu conduire une réaction avec une énantiosélectivité élevée en utilisant des catalyseurs à base de complexes de cuivre. Cependant, avant ce travail, il y avait encore des questions sur le mécanisme de cette réaction. le chimiste Vladimir Larionov, un employé du Département de Chimie Inorganique de l'Université RUDN, dans des expériences utilisant de nouveaux complexes de cuivre(II), ont montré que la molécule d'eau joue un rôle crucial dans la réaction d'Henry et est directement impliquée dans le cycle catalytique. Précédemment, les scientifiques n'y ont pas prêté beaucoup d'attention, mais seulement indiqué le fait que la vitesse de réaction augmente de plusieurs ordres avec la participation de l'eau.
Ces complexes peuvent être utilisés pour produire des précurseurs de médicaments tels que le (S)-propranolol (β-bloquant), (R)-norépinéphrine et (R)-salbutamol (agonistes des récepteurs β), amprénavir-Vertex 478 (inhibiteur de la protéase du VIH) et L-acosamine (classe d'antibiotiques anthracyclines).
Il était connu d'après des études antérieures que la réaction asymétrique de Henry est mieux réalisée dans les solvants aqueux et alcooliques. Par conséquent, les auteurs de l'étude ont testé la réaction dans des solvants (méthanol, aldéhyde-nitrométhane-eau) avec deux systèmes catalytiques :les complexes de cobalt (III) et de cuivre (II). Dans le cas du complexe de cobalt, l'ion métallique n'a pas participé à la réaction, et l'ion cuivre pourrait coordonner la molécule d'eau (ou les molécules). La réaction a été plus rapide avec le complexe de cuivre, et les chimistes ont obtenu plusieurs types de produits chimiques nécessaires (ligands et alcool nitré). Le catalyseur au cobalt fonctionnait moins bien, notamment dans la production d'alcool nitré. Ainsi, les auteurs ont décidé de se concentrer sur le catalyseur au cuivre.
Cependant, l'utilisation d'un catalyseur au cuivre dans le méthanol a également posé des problèmes. La formation d'alcool nitré de la seule forme racémique a été observée au cours de la condensation. Dans ce cas, la vitesse de réaction n'a pas ralenti, et le blocage du centre catalytique de l'ion cuivre ne s'est pas produit. Des calculs ont montré que l'eau forme une forte liaison entre le centre du cuivre et le groupe carbonyle. La réaction est terminée en une heure, et le rendement en alcool nitré atteint 61 %. À la fois, l'alcool nitré a été déplacé par l'eau et n'a pas bloqué le centre catalytique du complexe de cuivre. Ainsi, contrairement aux idées précédentes, il a été montré que l'eau améliore les propriétés catalytiques des complexes de cuivre.
Les chimistes ont conclu que l'efficacité des catalyseurs chiraux précédemment étudiés à base de cuivre (II) était sous-estimée car la teneur en eau (ou en alcool) de la réaction n'était pas prise en compte et n'était pas évaluée. Ces recherches ouvriront la voie à l'étude du mécanisme de la réaction d'Henry et à la création de nouveaux systèmes catalytiques à base de complexes de cuivre.