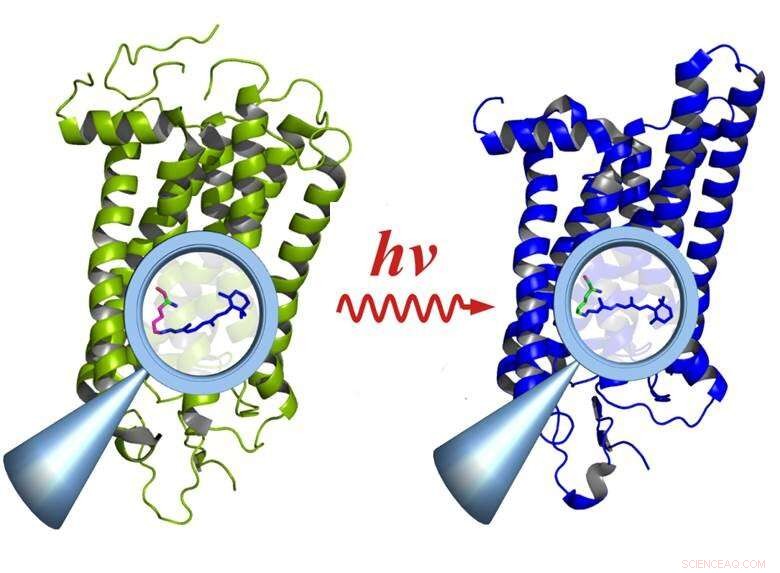
Rhodopsine avant (à gauche) et après activation par la lumière (à droite) :L'activation provoque des changements dans les groupes fonctionnels à l'intérieur de la molécule (loupe), qui affectent la molécule entière. Crédit :E. Ritter/HZB
La spectroscopie infrarouge à résolution temporelle dans la gamme inférieure à la milliseconde est une méthode importante pour étudier la relation entre la fonction et la structure dans les molécules biologiques. Cependant, la méthode ne fonctionne que si la réaction peut être répétée plusieurs milliers de fois. Ce n'est pas le cas pour un grand nombre de processus biologiques, bien que, car ils reposent souvent sur des réactions très rapides et irréversibles, par exemple en vision. Les quanta de lumière individuels entrant dans les bâtonnets de la rétine activent les molécules de protéine de rhodopsine, qui se désintègrent ensuite après avoir rempli leur fonction de phototransduction.
Aujourd'hui, une équipe dirigée par le Dr Ulrich Schade (HZB) et le Dr Eglof Ritter (Humboldt-Universität zu Berlin) de la ligne de lumière IRIS de BESSY II a développé un nouvel instrument capable de détecter ce type de réactions très rapides et/ou irréversibles avec une seule mesure. La résolution temporelle est de quelques microsecondes. L'instrument, un spectromètre Féry, utilise un détecteur hautement sensible connu sous le nom de réseau de détecteurs à plan focal et une optique spéciale pour tirer le meilleur parti du rayonnement infrarouge brillant de la source synchrotron BESSY II. L'équipe a utilisé cet appareil pour observer pour la première fois l'activation de la rhodopsine dans des conditions quasi in vivo.
"Nous avons utilisé la rhodopsine car elle se désintègre de manière irréversible après avoir été excitée par la lumière et constitue donc un véritable test acide pour le système, " explique Ritter, premier auteur de l'étude. La rhodopsine est une molécule de protéine qui agit comme un récepteur et est le pigment visuel présent dans les bâtonnets de la rétine de l'œil. Même des photons uniques peuvent activer la rhodopsine, permettant à l'œil de percevoir des niveaux de lumière extrêmement faibles. De plus, la rhodopsine est l'élément commun d'une classe de récepteurs avec des centaines de membres qui sont responsables de l'olfaction, goût, sensation de pression, réception hormonale, etc. - qui fonctionnent tous de la même manière.
L'équipe a également étudié pour la première fois une autre protéine passionnante dans le domaine infrarouge :l'actinorhodopsine. Cette molécule est capable de convertir l'énergie lumineuse en courant électrique, une propriété que certaines bactéries utilisent pour générer de l'énergie électrochimique pour leur métabolisme.
"La nouvelle méthode nous permet d'étudier les mécanismes de réaction moléculaire de tous les processus irréversibles (ou processus cycliques lents), tels que ceux dans le domaine de la conversion et du stockage de l'énergie, par exemple, " a souligné Schade, qui dirige l'équipe IRIS.