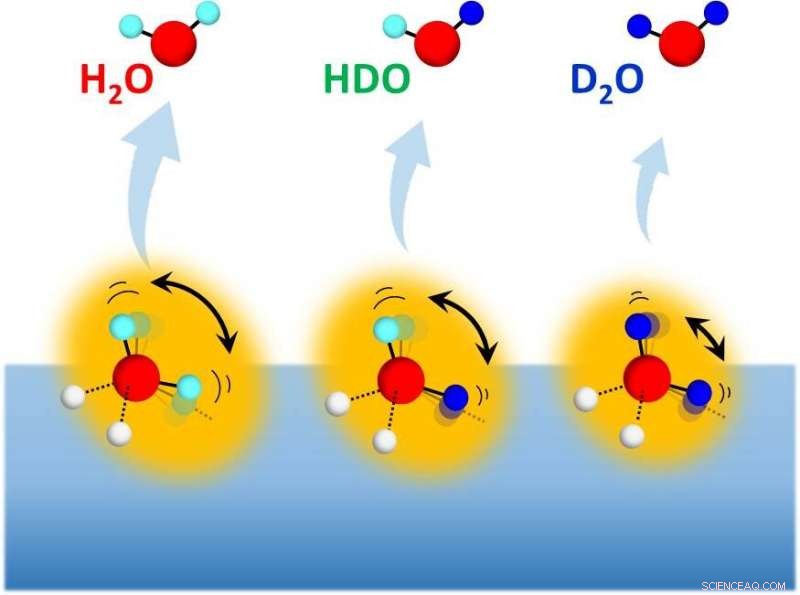
Désorption des isotopomères de l'eau (H
La nature quantique des liaisons hydrogène dans l'eau se manifeste par des effets isotopiques physico-chimiques particuliers :alors que la deutération allonge et affaiblit souvent les liaisons hydrogène des systèmes à liaison hydrogène typiques composés de molécules constituantes volumineuses, il allonge mais renforce les liaisons hydrogène des agrégats moléculaires d'eau. L'origine de cet effet isotopique unique des molécules d'eau reste à élucider au niveau moléculaire. Une étude expérimentale récente sur la sublimation de la glace d'eau mélangée à des isotopes a abordé cette question.
Les propriétés physico-chimiques et biologiques des systèmes à liaison hydrogène sont significativement affectées par les effets quantiques nucléaires, y compris les énergies du point zéro des modes vibrationnels, délocalisation des protons, et effet tunnel. Ceux-ci proviennent de la masse nucléaire extrêmement faible de l'hydrogène; Donc, les systèmes à liaison hydrogène présentent des effets isotopiques remarquables lors de la deutération. Dans les années 1930, Ubbelohde a d'abord proposé que la deutération allonge et affaiblit les liaisons hydrogène dans de nombreux systèmes à liaison hydrogène. Depuis, un tel effet isotopique a été largement confirmé et est aujourd'hui bien connu sous le nom d'effet Ubbelohde. En revanche, la deutérisation des molécules d'eau dans l'eau liquide et la glace allonge mais renforce les liaisons hydrogène. Malgré des études expérimentales et théoriques intensives pendant plus de trois quarts de siècle, l'origine au niveau moléculaire de cet effet isotopique particulier sur les liaisons hydrogène de l'eau n'est pas claire.
Récemment, chercheurs dirigés par Toshiki Sugimoto, professeur agrégé à l'Institut des sciences moléculaires, ont abordé le mystère de longue date : Comment faire un D plus étendu
Le concept le plus important est que l'effet de deutération (1) dérivé du mouvement de rotation joue un rôle crucial dans le processus de rupture de liaison de molécules extrêmement petites et légères. Dans le cas des agrégats d'eau, une énorme différence isotopique dans l'énergie du point zéro de la rotation entravée fait ressortir une nature particulière de l'effet de renforcement de la liaison (1) écrasant par rapport à l'effet d'affaiblissement de la liaison (2), conduisant à l'effet isotopique unique :les molécules d'eau deutérées forment des liaisons hydrogène plus longues mais plus fortes que les molécules d'eau hydrogénées. En revanche, dans le cas d'autres systèmes à liaison hydrogène typiques composés de molécules constitutives plus grosses et plus lourdes, tels que l'acide oxalique dihydraté, acide benzoique, acide succinique, et cyclohexane/Rh(111), les différences isotopiques dans l'énergie du point zéro de la rotation entravée sont négligeables. Par conséquent, seul l'effet d'affaiblissement de liaison (2) est prédominant dans l'effet isotopique sur leur énergie de liaison, résultant en des liaisons hydrogène plus longues et plus faibles dans les systèmes deutérés que dans les systèmes hydrogénés. Ainsi, les différences isotopiques dans la force des liaisons hydrogène sont déterminées par un équilibre délicat entre les deux effets de deutération concurrents (1) et (2), tandis que ceux en longueur de liaison hydrogène, c'est-à-dire l'effet isotopique géométrique, sont essentiellement dominées par l'effet de deutération (2).
"Ces résultats et concepts fournissent une nouvelle base pour notre compréhension fondamentale des liaisons hydrogène hautement quantiques de l'eau, " dit Sugimoto.