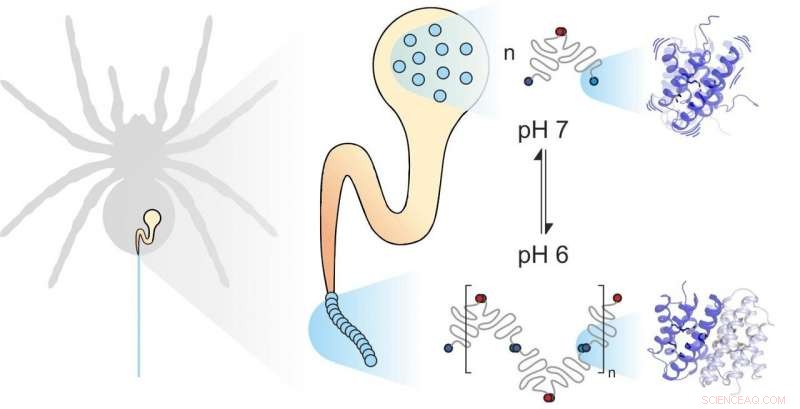
La soie d'araignée est composée de protéines individuelles. Des facteurs mécaniques et chimiques influencent leur assemblage. La dynamique des sous-unités joue un rôle important. Crédit :Benedikt Goretzki, Ute Hellmich
La soie d'araignée est constituée de protéines formant des fibres, stocké par l'araignée dans une glande spécialisée. Quand l'araignée a besoin de soie, par exemple pour construire un site Web, il extrude les protéines de la soie à travers un long conduit dans lequel elles sont exposées à des influences mécaniques et chimiques spécifiques et assemblées pour former de la soie. Protéines de soie d'araignée, comme toutes les protéines, se composent de 20 blocs de construction élémentaires appelés acides aminés. Le nombre et la séquence de ces acides aminés déterminent les propriétés des protéines individuelles. Par exemple, si des acides aminés hydrophobes tels que la leucine sont situés au centre d'une protéine, le résultat est une stabilité structurelle considérable. Ainsi, vous pouvez vous attendre à ce que la soie d'araignée extrêmement résistante contienne beaucoup de leucine. A leur grande surprise, cependant, des scientifiques des universités de Mayence et de Wurtzbourg ont découvert qu'un autre élément constitutif, méthionine, est très abondant dans certaines protéines de soie d'araignée.
Les chaînes latérales de la méthionine sont connues pour être très flexibles. "C'est cette abondance de méthionine dans la protéine de soie d'araignée qui nous a fait examiner de plus près sa dynamique, " a déclaré le professeur Ute Hellmich de l'Université Johannes Gutenberg de Mainz (JGU). " Notre collaboration avec l'équipe du Dr Hannes Neuweiler de la Julius-Maximilians-Universität Würzburg (JMU) nous a donné accès à des outils de recherche biophysique de pointe. "
Le groupe de Würzburg a systématiquement substitué l'acide aminé méthionine dans les protéines de soie d'araignée par de la leucine et a comparé le repliement, stabilité, et la dynamique des variantes protéiques résultantes à l'aide de la spectroscopie de corrélation de fluorescence par transfert d'électrons photo-induite (PET-FCS). Le Dr Hannes Neuweiler a joué un rôle déterminant dans le développement de cette technique, et son laboratoire est un chef de file mondial en l'utilisant pour étudier les systèmes biologiques. L'équipe du professeur Ute Hellmich a ensuite étudié la structure et la dynamique des deux variantes protéiques à l'aide de la spectroscopie par résonance magnétique nucléaire (RMN) à haute résolution. « Nous effectuons nos mesures RMN au Centre de résonance magnétique biomoléculaire de l'Université Goethe de Francfort - un autre exemple du potentiel généré par notre coopération dans le réseau universitaire Rhin-Main, " a souligné Hellmich.
Les blocs de construction de méthionine dans les protéines de soie d'araignée offrent une flexibilité
La combinaison de la spectroscopie PET-FCS et RMN a conduit les deux groupes de recherche à la conclusion inattendue que la méthionine dans la protéine de soie d'araignée augmente la flexibilité de la structure de la protéine, et que cette flexibilité est précisément ce qui permet aux protéines individuelles de la soie d'araignée d'interagir étroitement. "Nous avons constaté que la substitution de la méthionine par la leucine n'a aucun effet sur la structure de la protéine de soie d'araignée. En fait, les deux protéines ont exactement la même apparence. À la fois, cependant, la protéine naturelle contenant de la méthionine se lie beaucoup plus fortement aux autres protéines de la soie d'araignée. La protéine contenant de la leucine que nous avons synthétisée en laboratoire perd en grande partie cette capacité à former des liens aussi stables, " a souligné Benedikt Goretzki, doctorant dans l'équipe de Hellmich et l'un des deux principaux auteurs de l'étude publiée dans Communication Nature . "Nous avons été vraiment étonnés, car cela montre que ce n'est pas seulement la forme d'une protéine qui détermine son fonctionnement mais aussi, à un degré considérable, sa flexibilité."
"La méthionine rend non seulement la protéine plus dynamique, il améliore également sa fonctionnalité. En effet, il permet à deux protéines de s'interconnecter spécifiquement, ce qui serait autrement impossible, même s'ils avaient la même structure, " a précisé Julia Heiby, doctorant dans le groupe Neuweiler et l'autre auteur principal de l'étude.
"La forme suit la fonction" est une règle empirique en biologie structurale. En d'autres termes, ce qu'une protéine fait habituellement peut être déduit de sa structure tridimensionnelle. « Il est impressionnant de voir comment la nature peut également influencer la fonction des protéines en adaptant précisément leur dynamique, " a ajouté le biochimiste basé à Mayence, le professeur Ute Hellmich.
Sur la base de ces constatations, il est désormais possible de modifier sélectivement les propriétés des protéines de la soie d'araignée, par exemple, pour synthétiser de nouveaux biomatériaux hautement stables. En outre, les deux groupes espèrent également fournir des informations générales sur la pertinence de la dynamique des protéines par rapport à leurs fonctions biologiques. "La dynamique des protéines est importante dans tous les aspects de la vie, " conclut Hellmich. "C'est vrai pour les araignées et les humains."