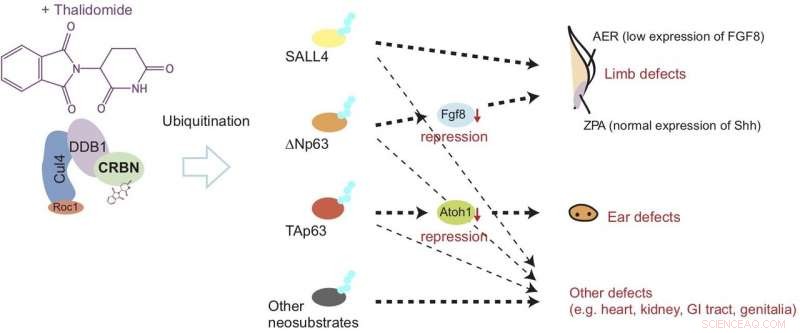
La thalidomide se lie au céréblon (CRBN) et provoque un développement anormal des membres et des oreilles en induisant la dégradation des protéines appelées ?Np63α et TAp63α par un processus connu sous le nom d'ubiquitination. Ce modèle suggère que les défauts sont déclenchés par la régulation négative de facteurs de croissance appelés Fgf8 et Atoh1. Crédit: Nature Chimie Biologie
Des chercheurs au Japon et en Italie ont approfondi leur compréhension de la manière dont la thalidomide provoque des anomalies du développement au niveau moléculaire. Une étude internationale co-écrite par des chercheurs de l'Institut de technologie de Tokyo (Tokyo Tech) et de l'Université médicale de Tokyo a dévoilé une vue détaillée de la façon dont la thalidomide, l'un des médicaments les plus notoires jamais développés, provoque des anomalies dans le développement des membres et des oreilles. Les résultats peuvent contribuer à la réémergence de la sécurité, ou non tératogène, médicaments dérivés de la thalidomide comme traitement du cancer et des maladies inflammatoires.
Utilisé à l'origine à la fin des années 1950 comme traitement contre les nausées matinales, des preuves au début des années 1960 associaient la thalidomide à des anomalies, notamment des membres raccourcis et des organes défectueux, qui a conduit à son interdiction dans le monde entier. Remarquablement, sur la base de découvertes ultérieures qui ont mis en évidence les propriétés anti-inflammatoires et autres propriétés bénéfiques de la thalidomide, le médicament est devenu un exemple majeur de celui qui peut être réutilisé pour traiter des conditions telles que la lèpre et le myélome multiple, un type de cancer du sang.
"La tragédie de la thalidomide n'est pas un cas ouvert et fermé dans l'histoire médicale, mais est en cours, comme de nouveaux bébés thalidomide sont nés après sa réapprobation vers 2000, " explique le biochimiste Yuki Yamaguchi de Tokyo Tech. " Mais nous savons maintenant que la thalidomide et ses médicaments dérivés sont très efficaces et sont associés à peu d'effets secondaires, à l'exception des effets tératogènes sur le fœtus, contrairement à de nombreux autres agents anticancéreux conventionnels. Par conséquent, la tératogénicité reste un obstacle majeur à une application plus large de ces médicaments prometteurs. »
Pour étudier plus en détail les mécanismes à l'origine de l'activité de la thalidomide, Yamaguchi a collaboré avec Hiroshi Handa de l'Université médicale de Tokyo, Luisa Guerrini de l'Universita degli Studi di Milano, Italie, et d'autres pour mener des études de développement en utilisant le poisson zèbre comme organisme modèle. Cette collaboration visait à explorer l'intuition de Guerrini selon laquelle la famille de protéines p63 pourrait être impliquée de manière critique. En 2010, une équipe dirigée par Handa et Yamaguchi a réalisé une percée en identifiant le céréblon comme une protéine clé par laquelle la thalidomide initie ses effets indésirables ou tératogènes.
Maintenant, la dernière étude publiée dans Nature Chimie Biologie montre qu'après s'être lié au cereblon, la thalidomide endommage les nageoires (correspondant aux membres) et les vésicules otiques (correspondant aux oreilles) en induisant la dégradation de deux types de protéine p63. Spécifiquement, l'étude suggère que la dégradation de ΔNp63α entraîne des anomalies des membres, tandis que celle de TAp63α conduit à des défauts de l'oreille, comme le montre la figure 1.
Comprendre comment cereblon agit pour médier les effets de la thalidomide pourrait transformer la façon dont les médicaments sont développés, s'éloignant d'une découverte fortuite et vers une conception moléculaire rationnelle. "Le changement serait comme un passage de la recherche d'une aiguille dans une botte de foin à la sculpture d'une aiguille dans de l'os, " note Yamaguchi.
"Il est probable que nous verrons le développement de nouveaux médicaments à base de thalidomide sans effets tératogènes dans un avenir proche, " il dit.