
Crédit :CC0 Domaine Public
Hydrogène, l'élément le plus abondant de l'univers, emballe un coup de poing puissant. Et parce qu'il ne contient pas de carbone, il ne produit que de l'eau lorsqu'il est utilisé comme combustible. Mais sur Terre, l'hydrogène existe le plus souvent en combinaison avec d'autres éléments, ce qui signifie qu'il doit être extrait.
Pour exploiter la puissance propre de l'hydrogène pour des applications énergétiques et d'autres usages, les chercheurs étudient des moyens abordables de produire et de stocker de l'hydrogène.
Une nouvelle recherche du Pacific Northwest National Laboratory (PNNL) montre qu'un appariement d'humbles minéraux surpasse les autres métaux précieux lorsqu'il s'agit de produire de l'hydrogène. Avec des collaborateurs de l'Oregon State University (OSU), les chercheurs ont testé un catalyseur au molybdène-phosphure (MoP) avec des eaux usées dans un petit réacteur appelé cellule d'électrolyse microbienne (MEC). Les résultats des tests ont montré que MoP fonctionnait mieux que le platine, un métal précieux et cher généralement utilisé pour ses hautes performances catalytiques. Le catalyseur MoP a également produit de l'hydrogène cinq fois plus rapidement que d'autres catalyseurs sans platine rapportés dans des études connexes.
Mais le vrai kicker ? Leur catalyseur fonctionnait également bien avec l'eau de mer.
"Si vous pouvez produire de l'hydrogène à partir de l'eau de mer, le pool de ressources est quasiment illimité, " dit Yuyan Shao, un scientifique des matériaux au PNNL qui a dirigé la recherche sur les catalyseurs.
Comme l'eau de mer, le matériau catalyseur MoP est largement disponible, et donc, pas cher. Le catalyseur a également fonctionné avec les eaux usées, une autre ressource omniprésente.
Les détails de l'étude de l'équipe apparaissent dans le journal Catalyse ACS . Les résultats découlent d'un projet de trois ans financé par le bureau des technologies des piles à combustible du ministère de l'Énergie.
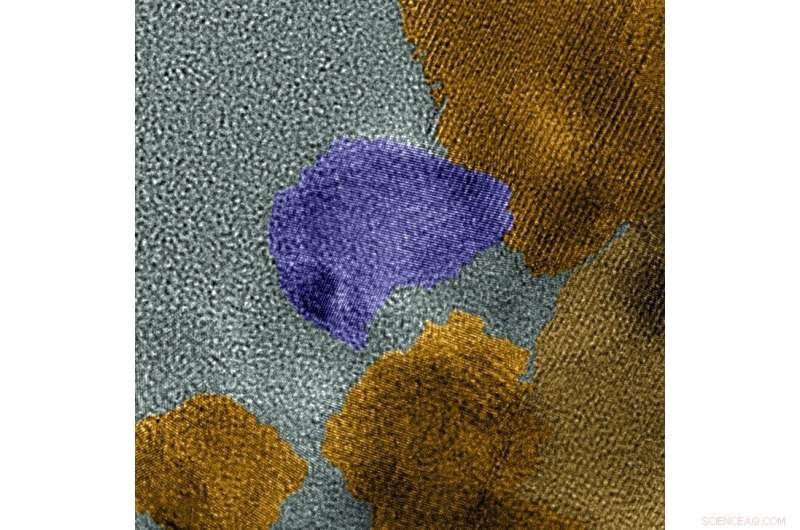
Cette image colorisée au microscope MET haute résolution montre les deux phases du catalyseur, MoP en violet, MoP2 en jaune. Crédit :Laboratoire des sciences moléculaires de l'environnement
Une meilleure alternative
L'une des méthodes les plus courantes pour produire de l'hydrogène est un processus appelé électrolyse. Ce procédé combine l'électricité avec divers produits chimiques, appelés électrolytes, et un matériau catalyseur solide. La réaction qui s'ensuit produit de l'hydrogène, mais l'ensemble du processus utilise beaucoup d'énergie et des ressources coûteuses comme le platine.
La fermentation à l'aide de sources renouvelables ou de flux de déchets est prometteuse pour une production d'hydrogène abordable. Mais le processus de fermentation fonctionne lentement, les rendements sont faibles, et le flux de produit nécessite un nettoyage coûteux en raison d'autres sous-produits de la fermentation. Dans les CEM, un courant électrique est couplé à des bactéries pour décomposer les matières organiques et produire de l'hydrogène. Malheureusement, les cellules utilisent également du platine coûteux pour la surface de réaction, et si des catalyseurs autres que le platine sont utilisés, les rendements en hydrogène restent faibles.
Chez OSU, les chercheurs ont développé une conception MEC hybride dans laquelle la fermentation et l'électrolyse ont lieu dans un seul pot au lieu d'étapes séparées, et les sous-produits sont directement consommés dans le processus. Cette conception intégrée augmente la productivité et réduit les coûts d'équipement. Mais avec le coût élevé du platine, l'équipe avait besoin d'un catalyseur capable de réduire les coûts de production à environ deux dollars par kilogramme d'hydrogène.
Surprise de deuxième phase
S'appuyant sur des découvertes antérieures avec le catalyseur MoP, Les chercheurs du PNNL ont étudié le catalyseur à utiliser dans les MEC. L'équipe de recherche a commencé avec la combinaison MoP en raison de son affinité pour l'activation, ou séparer, molécules d'eau. Le catalyseur est également réglable - la quantité de chaque minéral peut être ajustée. Selon l'hypothèse de l'équipe, ce réglage optimiserait la quantité d'hydrogène produite en une seule réaction.
Ils avaient en partie raison.
Sous un microscope puissant, ils ont découvert que le catalyseur s'assemblait en un mélange de deux phases cristallines distinctes :MoP et MoP
"Nous ne nous attendions pas à la formation simultanée des deux phases cristallines, " a déclaré Shao. " Les deux phases fonctionnent bien mieux que la phase unique. "
Les chercheurs ont mené leurs expériences dans des conditions de pH neutre à la fois dans la cellule hybride d'OSU utilisant des eaux usées et dans un autre réacteur du PNNL utilisant de l'eau de mer, avec des résultats cohérents. Shao a déclaré que ces résultats donnent aux chercheurs l'assurance que la méthode est solide, élimine le platine et autres sous-produits, et est très prometteur pour faire progresser les technologies de l'hydrogène et des piles à combustible.