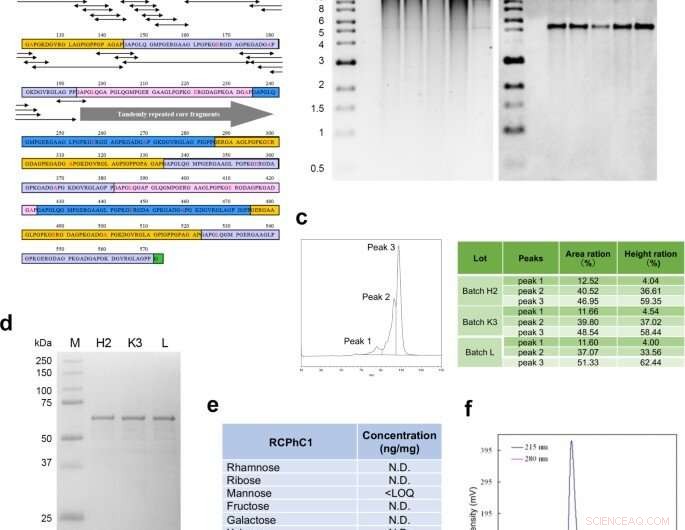
Conception moléculaire et synthèse du polypeptide recombinant RCPhC1. (a) La séquence peptidique de RCPhC1 montre des répétitions Gly-Xaa-Yaa avec des substitutions d'acides aminés (rouge). Tous les fragments peptidiques (séquences penta minimales) contenant les substitutions d'acides aminés (flèches à double tête) ont été appariés avec des séquences de collagène humain. (b) Stabilité de l'ADN génomique dans la banque de cellules de travail. Après chacune des quatre fragmentations consécutives, l'ADN génomique a été isolé (pistes 1 à 4) et comparé à l'ADN génomique original (piste 5). Le panneau de droite, Southern blot hybridé avec la sonde promoteur AOX1. (c) La reproductibilité a été analysée par chromatographie liquide. Le profil en phase inverse a montré trois pics, qui ont été systématiquement identifiés dans trois lots différents (H2, K3, et moi). (d) La reproductibilité a également été évaluée par SDA-PAGE. La bande unique de trois lots différents a également suggéré l'absence de modification post-traductionnelle. (e) L'absence de glycosylation post-traductionnelle. (f) La chromatographie par perméation de gel a confirmé la haute pureté de RCPhC1. Crédit :Nature Communications Materials, doi:10.1038/s43246-020-00089-9
L'étalon-or actuel pour la chirurgie de greffe osseuse comprend les autogreffes et les allogreffes, bien qu'il existe une demande croissante pour développer des biomatériaux synthétiques pour une bio-intégration améliorée dans l'ingénierie des tissus osseux. Dans un nouveau rapport maintenant publié le Documents de communication sur la nature , Hideo Fushimi et une équipe de recherche en biosciences et ingénierie, et la biotechnologie reconstructive au Japon et aux États-Unis, développé un matériau d'échafaudage biodégradable utilisant des protéines ou des polypeptides recombinants comme source de matériaux de greffe à base d'hydrogel. L'équipe a utilisé la chaîne alpha 1 du collagène humain de type I (en abrégé RCPhC1) comme source pour développer le polypeptide recombinant et a démontré la flexibilité du matériau pour concevoir des caractéristiques idéales pour les greffes osseuses. L'équipe a également développé des greffes osseuses RCPhC1 en utilisant un système hautement évolutif, protocole de production rationalisé pour la génération robuste de tissu osseux mature en laboratoire. Le greffon osseux s'est complètement résorbé après régénération tissulaire dans un modèle animal préclinique pour une intégration biologique efficace.
Ingénierie tissulaire osseuse avec biomimétique, greffes osseuses synthétiques
Dans ce travail, Fushimi et al. a développé un matériau synthétique de greffe osseuse en utilisant une protéine recombinante abrégée RCPhC1. Le développement fournit un matériau source polyvalent pour fabriquer des greffes osseuses synthétiques via une ingénierie flexible. En utilisant des études précliniques sur des modèles de défauts osseux canins et rongeurs, l'équipe a montré une efficacité améliorée des greffes osseuses pour régénérer le tissu osseux avec une maturité structurelle. En orthopédie clinique, la perte de volume et de fonction des tissus est une caractéristique des blessures, inflammation chronique, et les maladies métaboliques et génétiques. Alors que le tissu osseux peut se régénérer activement via la prolifération et la différenciation ostéogénique des cellules stromales ou souches mésenchymateuses, les défauts osseux importants nécessitent des interventions chirurgicales pour réparer et reconstruire les os avec des matériaux de greffe osseuse.
Globalement, les chirurgiens orthopédistes effectuent environ 2,2 millions de procédures de greffe osseuse par an sur un marché mondial extrêmement coûteux. Le tissu osseux humain est composé d'une matrice extracellulaire organique, minéraux de calcium et de phosphore cristallisés qui forment l'hydroxyapatite. Les matériaux de greffe osseuse peuvent imiter la structure et la composition biochimique du tissu osseux. Les chirurgiens orthopédistes et les chercheurs ont utilisé des greffes osseuses autologues (cellules et tissus obtenus d'un même individu) pour réparer les défauts osseux dus à des problèmes minéraux et immunologiques, bien que les complications sur les sites de la chirurgie puissent conduire à des méthodes de greffe alternatives telles que les allogreffes (cellules et tissus obtenus à partir d'un individu différent). Le nouveau développement du biomimétique, Les biomatériaux synthétiques pour l'ingénierie du tissu osseux répondent à un besoin urgent dans l'industrie de la santé de développer de nouveaux matériaux de greffe sans utiliser de tissu humain ou animal.
Facteurs de contrôle d'ingénierie pour développer des structures isotropes à matrice de glace par coulée par congélation en couche mince (TLFC). (a) Schéma de l'appareil de coulée par congélation. (b) Mesure typique de la température du fond de la coupelle de refroidissement (bleu) et de la surface du soluté (rouge) pendant le processus de lyophilisation. Il y avait un écart significatif entre la coupelle de refroidissement et la surface du soluté pendant la période de congélation. (c) Diagramme de la structure anisotrope à matrice de glace et de la microstructure réelle RCPhC1 contenant la zone de petits pores. La barre d'échelle équivaut à 500 μm. d TLFC a réduit l'écart de température entre la coupelle de refroidissement (bleu) et la surface du soluté (rouge) pendant la période de congélation. (e) L'effet de la température minimale et de la durée de refroidissement sur la structure des pores internes isotropes. La structure uniforme des pores (bleu) s'est développée lorsque la température minimale était inférieure à −10 °C mais n'a pas été affectée par la durée du refroidissement. La structure irrégulière des pores internes (rouge) s'est développée plus fréquemment lorsque la température minimale était supérieure à -10 °C. La barre d'échelle équivaut à 500 μm. La zone verte montre le nombre de gâteaux uniformément lyophilisés. La zone rouge montre le nombre de gâteaux lyophilisés irrégulièrement. (f) L'effet de la température du bloc sur la taille des pores internes. Les diamants montrent des valeurs médianes. Les températures de bloc inférieures ont augmenté le nombre de petits pores. La barre d'échelle équivaut à 500 μm. (g) La structure interne développée par l'agitation (cercles rouges), Les méthodes de coulée par congélation anisotrope (cercles verts) et isotrope (cercles bleus) ont été évaluées par des analyses d'absorption d'eau et de décomposition acide. Les éponges RCPhC1 ont été provisoirement réticulées par déhydrothermie à 130 °C pendant 7 h. Les lignes bleues dans les panneaux b et d indiquent l'enregistrement de la température du thermocouple au bas des solutions. Les lignes rouges indiquent qu'à la surface de la solution. Crédit :Nature Communications Materials, doi:10.1038/s43246-020-00089-9 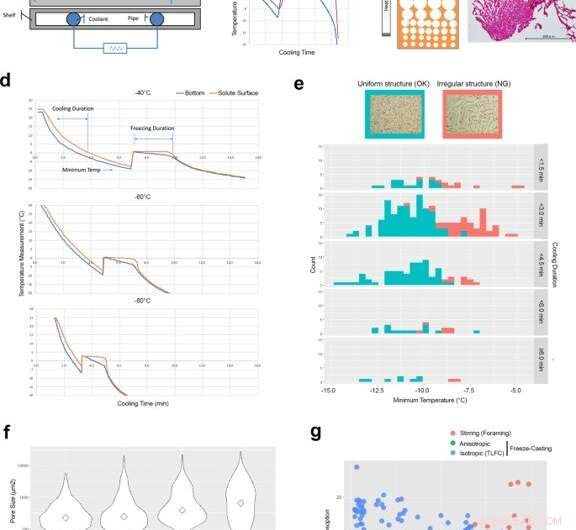
L'équipe a utilisé du collagène de type I, abondamment exprimé dans les tissus conjonctifs et les membranes interstitielles en tant que composant organique majeur du tissu osseux. La séquence protéique du collagène de type I joue un rôle important dans l'établissement de la résistance mécanique de l'os. L'équipe a d'abord cloné l'ADN complémentaire (ADNc) - une copie d'ADN d'une molécule d'ARN messager (ARNm) qui code pour le polypeptide (séquence protéique) RCPhC1, en un vecteur d'expression. Pour y parvenir, ils ont utilisé une espèce de levure méthylotrophe connue sous le nom de Pichia pastoris pour transférer la séquence et générer des banques de cellules maîtresses et de travail. L'équipe a confirmé la composition en acides aminés du polypeptide synthétique et a largement caractérisé le produit.
Ils ont ensuite conçu la structure interne du matériau de greffe pour répondre aux exigences spécifiques du tissu cible. Pour générer une structure de pores uniforme, donc, Fushimi et al. a conçu un protocole de coulée par congélation en couche mince (TLFC). L'approche de congélation polyvalente a généré un grand nombre de pores à parois minces pour former un échafaudage RCPhC1 isotrope avec diverses structures internes.
Facteurs d'ingénierie affectant la réticulation déshydrothermale de RCPhC1 pour contrôler le taux de biodégradation et la résistance mécanique. (a) L'effet de la température de réticulation et de la durée de réticulation sur le taux de biodégradation évalué par une analyse de décomposition acide in vitro. (b) La température de réticulation n'a pas influencé de manière linéaire le taux de survie de la décomposition acide. Compte tenu de la stérilisation en aval, la température de réticulation a été fixée à 130 °C. (c) La durée de la réticulation s'est avérée être le facteur de contrôle prédominant, qui a augmenté linéairement le taux de survie par décomposition acide de RCPhC1 jusqu'à 10 h. La matière de gélatine porcine a répondu de manière similaire à la durée de réticulation, bien que nécessitant une durée beaucoup plus longue. (d) Propriété physique du RCPhC1 réticulé déshydrothermal. La propriété physique équivalente de la gélatine porcine réticulée déshydrothermale nécessitait une durée de réticulation 10 fois plus longue. (e) La résistance mécanique du RCPhC1 réticulé déshydrothermal (130°C, 7 h) était significativement plus élevée que celle de la gélatine porcine réticulée déshydrothermale (130°C, 72 h). La barre d'erreur représente s.d. (f) RCPhC1 réticulé déshydrothermal (130°C, 7 h) a été traité à la trypsine et soumis à une LC haute performance. La co-migration de fragments peptidiques a indiqué de multiples sites de réticulation. Crédit :Nature Communications Materials, doi:10.1038/s43246-020-00089-9 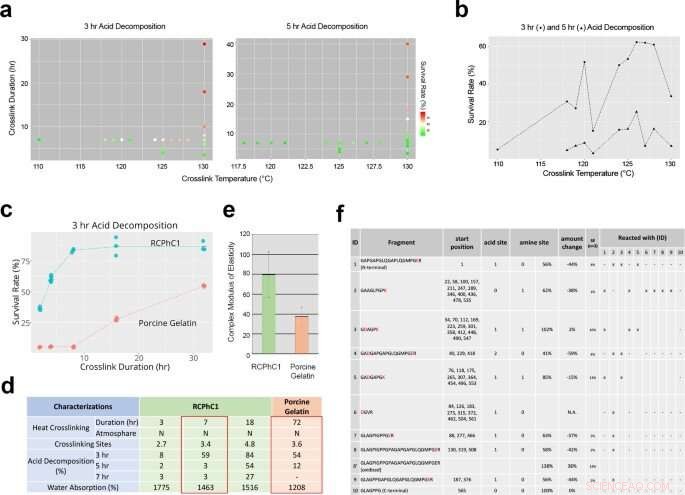
Fushimi et al. ensuite soumis le matériau à un traitement de réticulation déshydrothermique pour tester l'effet de la température et de la durée de réticulation sur sa composition. Après avoir testé le produit en aval pour la contamination microbienne, la température pendant le processus de fabrication s'est avérée efficace pour la stérilisation à la chaleur sèche. Des tests supplémentaires ont montré comment la composition unique en acides aminés de la protéine recombinante contribuait à son efficacité de réticulation hydrothermale robuste. L'équipe a ensuite optimisé le matériel protéique recombinant pour la greffe osseuse en régulant la concentration du matériel polypeptidique et sa température de congélation en fonction du volume d'os induit par la greffe dans un modèle de défaut osseux calvarial (crâne) de rat. Quatre semaines après avoir greffé le matériel dans le modèle animal, l'équipe a utilisé une estimation du volume osseux basée sur la tomodensitométrie (micro CT). Les résultats ont indiqué une concentration optimale de 7,5 pour cent de RCPhC1, une température de congélation de -40 à -60 degrés Celsius, et la réticulation déshydrothermale à 130 °C pendant 7 heures pour être mieux adaptée à la fabrication de matériau de greffe osseuse recombinant.
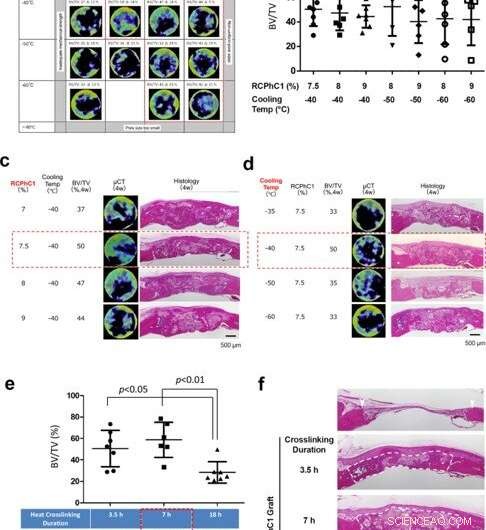
Optimisation des facteurs de contrôle de l'ingénierie. (a) Optimisation des facteurs combinés de la concentration en soluté RCPhC1 et de la température du bloc TLFC, avec la tentative de réticulation déhydrothermale à 130 °C pendant 7 h. La plage optimale a été réduite à une concentration de RCPhC1 comprise entre 7,5 et 9 % et une température de bloc TLFC comprise entre -40 et -60 °C (bloc en pointillé rouge). (b) Mesures BV/TV dans le groupe de la plage optimale de concentration de RCP1C1 et de température de refroidissement. Il n'y avait pas de différence statistique entre les groupes. (c) L'effet de la concentration de soluté de RCPhC1 sur la régénération osseuse. La barre d'échelle équivaut à 500 μm. (d) L'effet de la température du bloc TLFC sur la régénération osseuse. La barre d'échelle équivaut à 500 μm. (e) L'effet de la durée de la réticulation déshydrothermale sur la formation osseuse. (n = 7 ; test de comparaison multiple de Tukey) (f). L'effet de la durée de la réticulation déshydrothermale sur le maintien de l'espace de cicatrisation dans le défaut osseux de la calotte du rat. Les pointes de flèches blanches montrent les bords des défauts. Des lignes pointillées blanches entourent le tissu nouvellement formé. La barre d'échelle équivaut à 500 μm. Lignes horizontales en b, et e représente la moyenne ± s.d. Crédit :Nature Communications Materials, doi:10.1038/s43246-020-00089-9
Régénération robuste du tissu osseux vital dans des modèles précliniques avec des matériaux de greffe
Sur la base des conditions optimales vérifiées expérimentalement, Fushimi et al. a fabriqué les greffons osseux RCPhC1 avec des granules poreux. En utilisant le modèle de défaut osseux de la calotte du rat, ils ont montré comment la greffe osseuse induisait de manière robuste la régénération osseuse au sein de la structure des pores internes, en se dégradant progressivement in vivo, pour indiquer la biocompatibilité et la biointégration efficace. Ils ont comparé ce résultat avec une xénogreffe d'os spongieux décellularisé de bovin (vache) disponible dans le commerce et n'ont pas observé de régénération osseuse significativement plus importante. L'équipe a ensuite testé le matériau de greffe osseuse dans un modèle préclinique canin d'extraction dentaire pour comprendre la cicatrisation des plaies dans l'alvéole dentaire, où l'alvéole d'extraction traitée avec la greffe osseuse a montré une amélioration de la formation osseuse à 12 semaines. À ce moment, comme prévu, le greffon osseux a été largement remplacé par du tissu osseux.
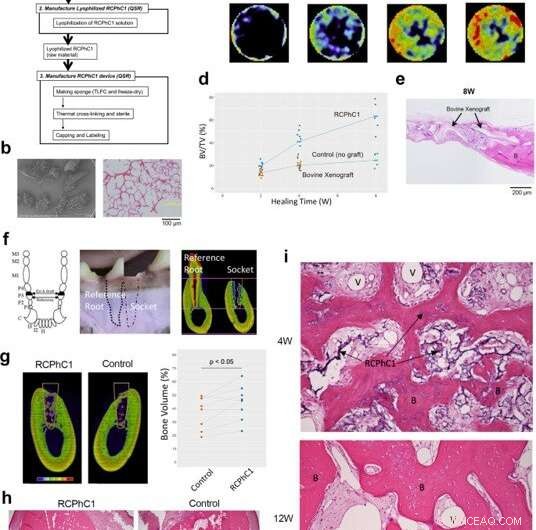
Test d'efficacité préclinique du matériau RCPhC1 optimisé pour la greffe osseuse chez des modèles rongeurs et canins. (a) Organigramme du processus de fabrication du greffon osseux RCPhC1. La barre d'échelle équivaut à 100 μm. (b) Le greffon osseux RCPhC1 a été préparé sous forme de granulés poreux de 300 à 1200 µm pour une meilleure manipulation. La barre d'échelle équivaut à 100 μm. (c) Décours temporel de la régénération osseuse induite par la greffe osseuse RCPhC1 dans le modèle de défaut de la calotte crânienne du rat. L'analyse histologique (rangée du haut) a révélé un tissu osseux nouvellement formé (B) dans le matériau de greffe RCPhC1, qui s'est résorbé avec le temps. Une série chronologique de microCT in vivo (rangée du bas) a représenté l'augmentation progressive du tissu osseux. (d) Décours temporel de la mesure BV/TV du défaut osseux de la calotte du rat implanté avec une greffe osseuse RCPhC1, xénogreffe d'os spongieux décellularisé bovine et aucun contrôle de greffe. (e) Évaluation histologique d'une xénogreffe bovine implantée dans un défaut osseux calvarial de rat. La structure physique de la xénogreffe bovine était similaire à celle de la greffe osseuse RCPhC1. A la périphérie du défaut, Une xénogreffe bovine a été vue fusionnée à l'os nouvellement formé (B). Au centre du défaut, Les granules de xénogreffe bovine étaient entourés de tissu fibreux. La barre d'échelle équivaut à 200 μm. (f) Modèle d'extraction de dent canine. La troisième prémolaire canine (P3) a des racines mésiales et distales presque identiques. La troisième prémolaire a été hémi-sectionnée et seule la racine distale a été extraite. Un côté de la cavité osseuse post-extraction a été rempli de RCPhC1 tandis que l'autre côté a été laissé à cicatriser sans autre traitement. La racine médiale restante a été traitée endodontiquement et a servi de référence. La barre d'échelle est égale à 4 mm. (g) Coupe transversale MicroCT illustrant la régénération osseuse dans l'alvéole d'extraction (ligne blanche) après 12 semaines (12 W) de cicatrisation. Le volume osseux à l'intérieur de l'alvéole était significativement plus important dans l'alvéole implantée avec greffe osseuse RCPhC1 que dans l'alvéole témoin non traitée (n = 8 ; test t apparié bilatéral). La barre d'échelle est égale à 4 mm. (h) Coupe transversale histologique de l'alvéole d'extraction (ligne blanche) à 12 W. L'alvéole qui a reçu une greffe osseuse RCPhC1 présentait une régénération osseuse plus importante. Les lignes blanches en pointillés indiquent les interfaces de socket. La barre d'échelle est égale à 1 mm. (i) Évaluation histologique de la régénération osseuse associée à la greffe osseuse RCPhC1 (I). Une formation vasculaire abondante (II) dans le tissu de la moelle osseuse a été notée de régénération osseuse (III) après 4 semaines (4 W) de cicatrisation. Le greffon osseux RCPhC1 était largement résorbé après 12 W de cicatrisation. L'os régénéré contenait des ostéocytes vitaux (IV). Crédit :Nature Communications Materials, doi:10.1038/s43246-020-00089-9
Perspectives des échafaudages synthétiques dans l'ingénierie du tissu osseux
De cette façon, Hideo Fushimi et ses collègues ont optimisé un simple, mais un processus d'ingénierie critique pour réguler la concentration en soluté d'un polypeptide recombinant de la protéine de chaîne alpha I du collagène humain de type I avec des substitutions d'acides aminés ciblées, abrégé en RCPhC1. L'équipe a d'abord implanté la construction dans un modèle de défaut osseux calvarial de rat pour comprendre les facteurs d'ingénierie optimaux pour fabriquer la greffe osseuse. Ils ont conçu le matériau de greffe osseuse pour soutenir la migration des cellules souches mésenchymateuses (CSM) vers la zone du défaut et ont fourni un microenvironnement stimulant pour la différenciation ostéogénique. Le matériau de greffe osseuse seul a montré un schéma de cicatrisation idéal en l'absence de facteurs de croissance et de cellules souches pour régénérer l'os. Le matériau peut être utilisé pour générer des dispositifs médicaux spécifiques aux tissus et des échafaudages de greffe avec une polyvalence de fabrication significative dans l'ingénierie des tissus osseux.
© 2020 Réseau Science X