
Des chercheurs de l'Université Rice ont développé un complexe à base de ruthénium capable de suivre la formation d'agrégats de peptides bêta-amyloïdes solubles impliqués dans l'apparition de la maladie d'Alzheimer. Crédit :Jeff Fitlow/Université Rice
Des chercheurs de l'Université Rice ont trouvé un moyen de suivre la formation d'agrégats de peptides bêta-amyloïdes solubles impliqués dans l'apparition de la maladie d'Alzheimer.
Le laboratoire Rice d'Angel Martí a signalé le développement d'un complexe fluorescent à base de ruthénium qui se lie aux substances solubles, peptides bêta-amyloïdes oligomères. Au fur et à mesure que les peptides se réunissent pour former les grandes biomolécules appelées oligomères, l'additif fluorescent les lie et les marque.
Cela permettra aux chercheurs de suivre facilement la progression et les mouvements des agrégats à mesure qu'ils grandissent au fil du temps. Les détails des travaux apparaissent dans le Journal de l'American Chemical Society .
Les plaques amyloïdes ont longtemps été suspectées d'être à l'origine de la maladie d'Alzheimer, mais des études récentes suggèrent que les oligomères – des molécules flottantes avec des unités peptidiques répétitives – font beaucoup plus de dégâts.
"Il existe une opinion sur le terrain selon laquelle les oligomères solubles sont la principale cause de la dégénérescence neuronale, car ces oligomères sont toxiques pour les neurones, " dit Marti, professeur agrégé de chimie, de la bio-ingénierie et de la science des matériaux et de la nano-ingénierie.
"Ces oligomères sont définitivement associés à la pathologie d'Alzheimer, il y a donc eu un besoin d'outils pour nous aider à les étudier."

Bo Jiang, étudiant diplômé de l'Université Rice, montre un flacon fluorescent d'agrégats de peptide bêta-amyloïde soluble impliqués dans l'apparition de la maladie d'Alzheimer. Les peptides sont marqués et suivis avec un complexe de ruthénium développé chez Rice qui peut les surveiller dans des expériences de laboratoire à mesure qu'ils grandissent au fil du temps. Crédit :Jeff Fitlow/Université Rice
Il a déclaré que les oligomères sont "virtuellement invisibles" pour les colorants de thioflavine T couramment utilisés pour marquer les fibrilles amyloïdes dans les études de laboratoire. Les complexes de ruthénium résolvent ce problème.
Les complexes profitent de l'anisotropie de fluorescence, dans laquelle la réponse fluorescente est polarisée, plus brillant dans certaines directions que dans d'autres. "C'est une technique très ancienne liée à la rotation des molécules, " dit Martí. "Quand la molécule est en solution, il bouge et tourne constamment. Quand c'est tout petit, il tourne très vite et l'anisotropie est presque nulle.
"Mais quand la même sonde se lie à une grosse macromolécule, il tourne plus lentement, " dit-il. " C'est comme ça que nous savons que nous avons des oligomères, et ensuite nous pourrons suivre leur croissance et leur propagation."
Des tests en laboratoire ont montré la formation d'oligomères en solution à différentes températures pendant des heures. Martí a noté que les solutions froides ralentissent le processus, mais à température corporelle, les oligomères se forment "très vite et en grande quantité. La vitesse à laquelle ils se forment aux températures physiologiques est remarquable".
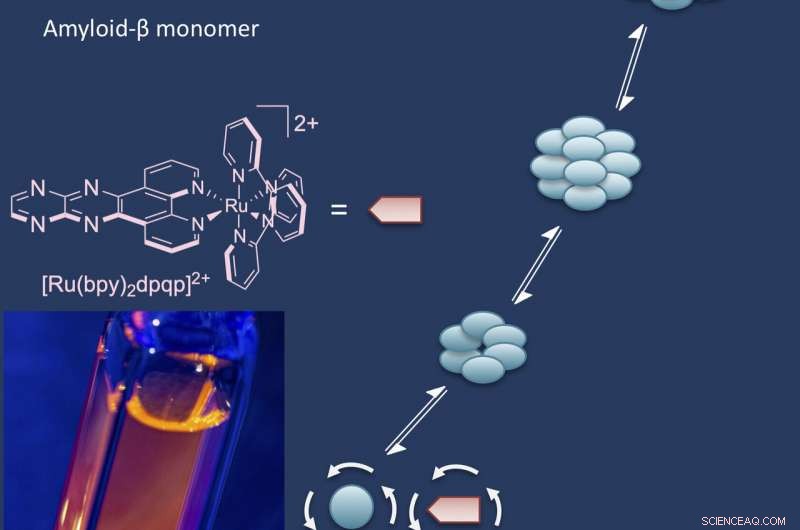
Une étiquette à base de ruthénium développée à l'Université Rice tire parti de l'anisotropie fluorescente pour mesurer la rotation des oligomères bêta-amyloïdes lorsqu'ils se développent en solution. Les petits agrégats tournent vite, tandis que les gros oligomères tournent lentement, une caractéristique qui permet aux chercheurs de surveiller leur croissance. Les oligomères bêta-amyloïdes sont toxiques pour les neurones et impliqués comme cause possible de la maladie d'Alzheimer. Crédit :Groupe Angel Martí/Université du riz
Le laboratoire Rice a également utilisé ses sondes pour voir comment les cellules de neuroblastome étaient affectées en temps réel lorsqu'elles étaient injectées avec des peptides bêta-amyloïdes. Ils ont révélé que seulement 60% des cellules injectées avec des oligomères restaient viables, tandis que ceux traités avec des fibrilles amyloïdes et des monomères avaient une viabilité plus élevée, environ 80%, suggérant que les oligomères sont en effet toxiques, dit Marti.
Pour l'instant, il a dit, les sondes au ruthénium sont destinées à être utilisées uniquement en laboratoire. "Il sera difficile de les utiliser dans le cerveau parce qu'il y a trop de diffusion de la lumière, " dit Martí. "Ils sont faits pour profiter de la lumière polarisée, et la dispersion atténuerait cela."
"Mais en tant qu'outil de laboratoire, ils permettront aux chercheurs du monde entier de tester les effets d'autres molécules sur le taux de formation d'oligomères, et c'est une grosse affaire, " at-il dit. " Ils peuvent voir rapidement si un médicament retarde ou arrête la formation d'oligomères. "