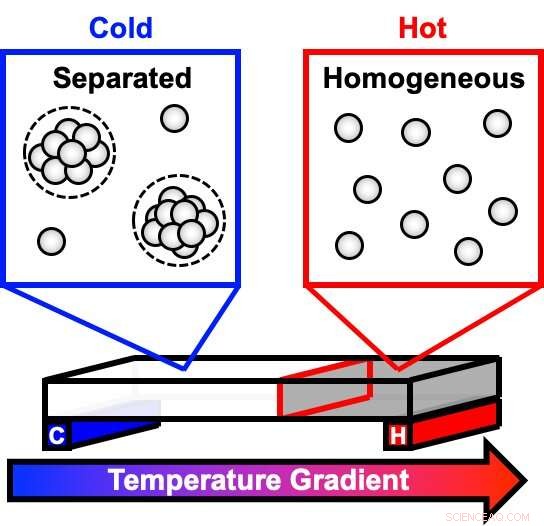
Une nouvelle étude a utilisé un gradient de température pour observer à quel point les solutions d'anticorps hautement concentrées, comme ceux communs dans certains médicaments, séparer en phases, comme une solution d'huile et d'eau. À des températures plus froides, des gouttelettes troubles commencent à se former dans la solution une fois limpide. Au fur et à mesure que les gouttelettes grandissent et se déposent au fond du récipient, la solution se sépare en deux phases distinctes. Cette séparation de phases peut affecter la durée de conservation et la stabilité d'un médicament. Crédit :Cremer Lab, État de Pennsylvanie
Un nouveau modèle mathématique décrit comment des solutions d'anticorps hautement concentrées se séparent en différentes phases, semblable à un mélange d'huile et d'eau. Cette séparation peut réduire la stabilité et la durée de conservation de certains médicaments qui utilisent des anticorps monoclonaux, y compris certains utilisés pour traiter les maladies auto-immunes et le cancer. Une équipe de scientifiques de Penn State et de MedImmune, LLC (maintenant AstraZeneca) a étudié la thermodynamique et la cinétique, les relations entre la température, énergie, et la vitesse des réactions chimiques, du phénomène à l'aide d'une méthode innovante qui permet l'étude rapide de plusieurs échantillons à la fois. Un article décrivant leur modèle paraît le 22 juillet 2019, dans la revue Actes de l'Académie nationale des sciences .
De nombreux médicaments sont aujourd'hui stockés sous forme de solides et dissous dans des poches IV pour être livrés aux patients, mais l'industrie pharmaceutique s'est tournée vers des médicaments qui peuvent être stockés sous forme liquide et administrés par injection. Certaines de ces solutions médicamenteuses, comme ceux utilisés pour traiter les maladies auto-immunes et certains cancers, contiennent des concentrations élevées d'anticorps monoclonaux - des protéines qui se fixent à des substances étrangères dans le corps, comme les bactéries et les virus, les signaler pour destruction par le système immunitaire du patient.
"Les solutions de protéines hautement concentrées peuvent se séparer en différentes phases, comme une vinaigrette se séparant en couches au fil du temps, " a déclaré Bradley Rogers, étudiant diplômé en chimie à Penn State et premier auteur de l'article. "La séparation de phases est l'une des voies qui rendent ces médicaments instables et impropres à l'utilisation. La méthode classique pour comprendre ce processus consiste à manipuler la température d'un échantillon au fil du temps. Nous avons utilisé une plate-forme de microfluidique à gradient de température pour examiner rapidement plusieurs températures simultanément. "
Une solution riche en anticorps commence comme un liquide clair à température ambiante, mais comme la solution refroidit, des gouttelettes troubles commencent à se former. Heures supplémentaires, les gouttelettes se déposent au fond, avec le liquide dilué restant sur le dessus, rendre l'échantillon clair. L'équipe a utilisé un dispositif innovant qui crée une plage de températures sur un gradient de température et a utilisé une technique appelée imagerie en champ sombre pour mesurer la vitesse à laquelle ce processus se produit. Ensuite, l'équipe a calculé une variété de paramètres pour mieux comprendre la thermodynamique et la cinétique du système, y compris les températures auxquelles les transitions de phase se produisent et la quantité d'énergie nécessaire pour passer d'une phase à l'autre, les énergies d'activation.
"Nous avons observé que la vitesse à laquelle une solution se sépare en deux phases a une étrange dépendance à la température, " a déclaré Rogers. " Cette relation est beaucoup plus compliquée pour les solutions d'anticorps concentrés que pour les autres systèmes. Nous avons passé beaucoup de temps à essayer de donner un sens aux données, mais nous avons finalement développé un modèle qui explique ce que nous voyons."
Le modèle décrit comment les molécules d'anticorps se collent lorsque la température diminue, formant des gouttelettes qui se développent à mesure que des molécules supplémentaires se joignent. Ce processus réversible se produit de plus en plus rapidement lorsque la température diminue, car la solution est de plus en plus saturée de molécules d'anticorps libres. Puis, au fur et à mesure que la solution refroidit, les gouttelettes se collent aux autres gouttelettes et se déposent au fond. À des températures encore plus froides, la solution forme un gel et ne peut pas terminer la séparation, même pendant un mois.
« Dans une seule expérience, on peut visualiser la solution claire homogène, la solution trouble lorsque des gouttelettes commencent à se former, le liquide à phases séparées, et le gel, " a déclaré Paul Cremer, Chaire J. Lloyd Huck en sciences naturelles à Penn State et auteur principal de l'article. "Des recherches antérieures décrivaient ces différents états, et notre modèle décrit les mathématiques et la cinétique dépendante de la température derrière ce que nous pensons qui se passe."
Prochain, l'équipe de recherche prévoit d'étudier si leur modèle peut expliquer la séparation de phases dans d'autres systèmes. Ils prévoient également de tester si les paramètres recueillis à partir de ce type d'expérience peuvent prédire la stabilité et la durée de conservation des produits thérapeutiques.
« Si ces paramètres peuvent nous aider à prédire la stabilité et la durée de conservation, we may be able to select better drug candidates, " said Rogers. "We may also be able to determine the ideal solution properties for a promising drug candidate to keep it stable."
In addition to Rogers and Cremer, the research team includes Kelvin Rembert, Matthew Poyton, Halil Okur, Amanda Kale, and Tinglu Yang at Penn State and Jifeng Zhang from AstraZeneca. The work was supported by MedImmune LLC (now AstraZeneca). Additional support was provided by the National Science Foundation.