Des chercheurs de l'Université Purdue ont découvert des agents anticancéreux potentiels qui stabilisent le promoteur MYC G-quadruplex et régulent négativement l'expression de l'oncogène MYC. Crédit :Université Purdue/Danzhou Yang
Un gène appelé MYC est devenu l'une des cibles les plus prisées des chercheurs sur le cancer du monde entier. MYC est connu pour stimuler la croissance tumorale dans presque tous les types de cancer, mais cibler avec succès le gène s'est avéré être un défi. Celui qui déconcerte les chercheurs depuis plus de trois décennies.
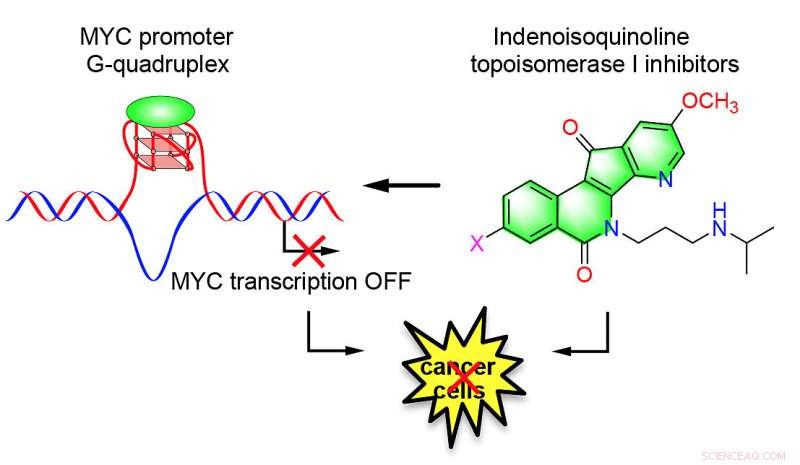
Maintenant, des chercheurs de l'Université Purdue ont découvert un nouvel ensemble de stabilisateurs G-quadruplex du promoteur MYC qui ont démontré une activité anticancéreuse dans des cultures de cellules cancéreuses humaines. La découverte est publiée dans l'édition du 8 juillet du Journal de l'American Chemical Society .
"Nous nous efforçons de découvrir des agents anticancéreux efficaces, " a déclaré Mark Cushman, un éminent professeur de chimie médicinale au Collège de pharmacie de Purdue, qui aide à diriger l'équipe de recherche. "La capacité d'incorporer l'activité stabilisatrice G-quadruplex du promoteur MYC dans les inhibiteurs de la topoisomérase I existants s'est révélée prometteuse en les rendant plus puissants en tant qu'agents anticancéreux et en rendant les cellules cancéreuses moins susceptibles de leur devenir résistantes."
L'équipe Purdue a découvert des agents anticancéreux potentiels qui ciblent le promoteur MYC G-quadruplex et régulent négativement l'expression de l'oncogène MYC, qui est surexprimé dans le cancer et est associé à presque tous les aspects du développement du cancer. Le travail a été soutenu par le National Cancer Institute et les National Institutes of Health.
Cushman, dont les travaux de recherche sur le cancer ont contribué à son élection en tant que membre de la National Academy of Inventors, ont déclaré avoir découvert une nouvelle classe de stabilisateurs G-quadruplex du promoteur indénoisoquinoléine MYC en collaboration avec Danzhou Yang. Certains d'entre eux inhibent également la topoisomérase I, une enzyme qui facilite la réplication de l'ADN et est produite en plus grande quantité dans les cellules cancéreuses.

Des chercheurs en cancérologie et en pharmacie de l'Université Purdue ont découvert un nouvel ensemble de stabilisants MYC qui ont démontré une activité anticancéreuse dans des cultures de cellules cancéreuses humaines. Sur la photo, Guanhui Wu, un doctorant, Mark Cushman, Danzhou Yang et Kaibo Wang, un chercheur associé postdoctoral. Crédit :Purdue Research Foundation/Hope Sale
« Le ciblage du promoteur G-quadruplexes offre une stratégie relativement nouvelle et passionnante pour inhiber l'expression critique des oncogènes dans les cellules cancéreuses, " dit Yang, la chaire Martha et Fred Borch de thérapie contre le cancer au Purdue's College of Pharmacy, qui a dirigé la recherche avec Cushman. "Nous espérons combiner la puissance des médicaments ciblés sur l'ADN et la sélectivité des approches ciblées moléculaires pour de nouvelles thérapies contre le cancer."
Yang et Cushman, tous deux membres du Purdue University Center for Cancer Research, ont déclaré que les agents qu'ils ont découverts pourraient être utilisés pour aider à traiter presque tous les types de cancer. Une partie de la technologie issue de leur travail a été concédée sous licence à Gibson Oncology LLC par le biais du Purdue Research Foundation Office of Technology Commercialization.
Certains des travaux que Cushman et son équipe ont précédemment développés ont conduit à trois agents anticancéreux qui sont en cours d'essais cliniques. L'innovation MYC augmentera considérablement l'intérêt pour ces agents anticancéreux au sein de la communauté scientifique et contribuera également à la compréhension de leur fonctionnement.