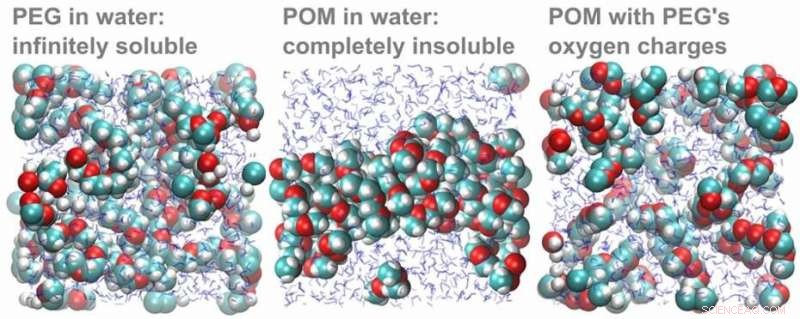
Simulations informatiques de molécules PEG et POM dans l'eau. À gauche :les molécules de PEG se dissolvent dans l'eau. Au centre :les molécules de POM ne se dissolvent pas dans l'eau, mais collent ensemble dans un morceau. À droite :lorsque la charge des atomes d'oxygène est modifiée à la valeur en PEG, les molécules de POM se dissolvent rapidement. Crédit :HIMS
Les molécules de polyéther ont tendance à mieux se dissoudre dans l'eau car elles contiennent plus d'oxygène et moins d'atomes de carbone. Mais il y a des exceptions très contre-intuitives à cette tendance, le plus connu étant le POM en plastique largement utilisé. Il a le rapport oxygène/carbone le plus élevé possible mais est totalement insoluble. Dans le numéro actuel de Communication Nature , des chercheurs de l'Université d'Amsterdam et de l'Institut Max Planck de recherche sur les polymères à Mayence ont maintenant avancé une explication définitive.
Les chercheurs ont notamment mis en lumière les différences de solubilité entre les polyéthers PEG (polyéthylène glycol) et POM (polyoxyméthylène) qui sont omniprésents dans notre quotidien. Le PEG a de nombreuses applications dans les solutions aqueuses à usage pharmaceutique et cosmétique, par exemple dans les crèmes pour le rasage et les soins de la peau. Le POM est une matière plastique omniprésente :de nombreux objets de la vie quotidienne sont en POM, tout comme les clips Keck aux couleurs vives pour connecter la verrerie, bien connu de tous les chimistes.
Bien que ces deux polyéthers se ressemblent beaucoup au niveau moléculaire, ils ont des solubilités dans l'eau très contre-intuitives. PEG (unité répétitive -CH
Mais attendez :POM (unité répétitive -CH
L'induction comme principe explicatif
Pour percer le mystère, les chercheurs d'Amsterdam et de Mayence ont utilisé une combinaison de spectroscopie infrarouge femtoseconde, expériences de relaxation diélectrique, calculs quantiques et simulations informatiques.
Les expériences ont montré que l'interaction eau-polymère, qui détermine la solubilité, dépend fortement du rapport carbone/oxygène du polymère. De façon intéressante, des calculs quantiques ont montré que cette dépendance n'est pas due à la distance entre les atomes d'oxygène dans la chaîne polymère. Cela a souvent été proposé, l'idée étant que la distance oxygène-oxygène dans le PEG s'intègre mieux dans le réseau de liaisons hydrogène de l'eau.
Dans Nature Communications, les chercheurs montrent maintenant que la relation entre le rapport carbone/oxygène et la solubilité implique une induction :les atomes d'oxygène sont chargés négativement car ils retirent la densité électronique des atomes de carbone voisins dans la chaîne polymère. En PEG, chaque atome d'oxygène a deux atomes de carbone voisins entièrement à sa disposition pour retirer la densité électronique. Dans POM, cependant, les atomes d'oxygène doivent "partager" les atomes de carbone entre eux, et peut donc retirer moins de densité électronique. Par conséquent, la charge négative partielle sur les atomes d'oxygène dans le POM est environ deux fois plus faible que dans le PEG. La notion d'induction expliquerait donc parfaitement pourquoi le POM est beaucoup moins hydrophile, et donc insoluble.
Confirmation élégante
Pour confirmer que la différence de charge partielle d'oxygène explique bien la différence de solubilité, les chercheurs théoriques de l'équipe ont réalisé une élégante expérience informatique. D'abord, ils ont simulé une solution de molécules POM, qui a précipité comme prévu. Lorsqu'ils ont ensuite changé les charges d'oxygène du POM en celles calculées pour le PEG, les charges POM avec PEG se sont rapidement dissoutes.
En plus de résoudre un mystère de longue date lié aux matériaux de tous les jours, les résultats montrent que les effets d'induction peuvent avoir un impact majeur sur les solubilités. La prise en compte de cet effet devrait permettre de prédire plus facilement les solubilités dans le futur.