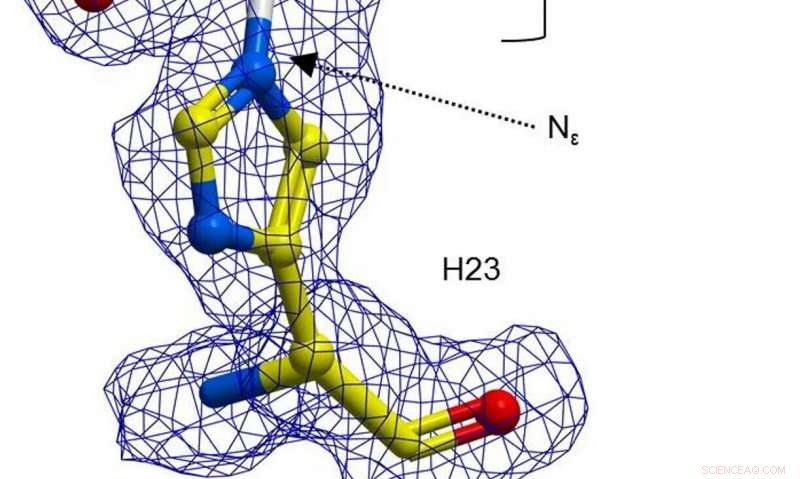
Une représentation en boule et en bâton de H23 de BH32 inhibée par la 2-bromoacétophénone, coloré par type d'atome avec des atomes de carbone H23 en jaune et des carbones d'acétophénone en blanc. Densité électronique claire FEM (bleu, profilé en 1σ) s'étend entre le Nε de H23 et l'acétophénone. Crédit: La nature (2019). DOI :10.1038/s41586-019-1262-8
Une équipe de chimistes de l'Université de Manchester a trouvé un moyen d'incorporer un résidu anormal dans une enzyme pour montrer comment la gamme catalytique des enzymes peut être élargie. Dans leur article publié dans la revue La nature , le groupe décrit l'élargissement de la gamme d'enzymes catalytiques qui pourraient être utilisées pour fournir une plus grande variété de chaînes latérales pour la catalyse, en utilisant un "alphabet" étendu d'acides aminés. Adam Nelson, avec l'Université de Leeds, a publié un article de News and Views Research discutant du travail de l'équipe dans le même numéro de la revue.
Comme le note Nelson, il n'y a pas beaucoup de résidus d'acides aminés naturels qui peuvent être utilisés par les enzymes pour catalyser des réactions - il note qu'il n'y a que 20 sortes qui peuvent être utilisées pour construire de telles enzymes. Ce manque d'options a conduit les chercheurs à se demander si la gamme d'acides aminés qui pourraient être utilisés par les enzymes pour permettre plus de réactions catalytiques pourrait être élargie, peut-être en utilisant ce que les chercheurs décrivent comme un « alphabet » d'acides aminés qui fournissent un plus large variété de chaînes latérales qui peuvent être utilisées pour la catalyse. Dans ce nouvel effort, les chercheurs ont utilisé un tel alphabet étendu d'acides aminés pour élargir l'éventail des possibilités. Ils rapportent qu'en agissant ainsi, ils ont pu construire une enzyme en utilisant des membres d'un groupe catalytique non naturel et ont montré que cela pouvait conduire à des améliorations en utilisant une approche appelée évolution dirigée.
Dans leur travail, les chercheurs ont choisi de remodeler une enzyme pour en faire un catalyseur plus efficace. Ils ont commencé par remarquer qu'un résidu d'acide aminé histidine dans l'enzyme BH32 peut former un composé acyl-enzyme intermédiaire. Cet intermédiaire a été hydrolysé pour créer un produit de la réaction, mais le résultat n'était pas comme prévu. L'équipe a ensuite utilisé l'évolution dirigée pour optimiser le rôle de la Nδ-méthylhistidine. Cela impliquait un certain nombre d'approches pour forcer les mutations. Par conséquent, l'équipe a découvert une variante appelée OE1.3, dont les tests ont montré qu'il était plus efficace. L'équipe a continué avec une évolution plus dirigée et est finalement arrivée à OE1.4, une enzyme qui a démontré une activité catalytique améliorée.
© 2019 Réseau Science X