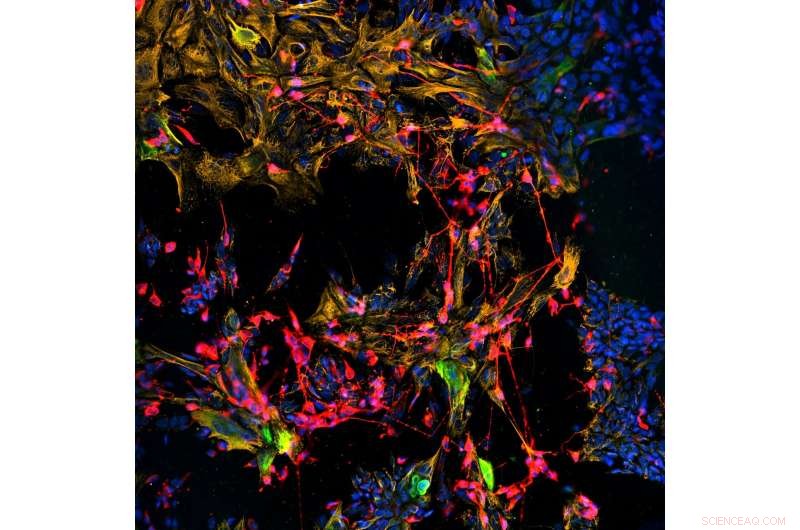
Les cellules basales horizontales (HBC) de souris cultivées conservent leur activité en tant que cellules souches et sont activées par un traitement à l'acide rétinoïque. Les HBC activés se différencient en neurones (marqueurs rouges) et en cellules de soutien non neuronales (marqueurs d'or) de l'épithélium olfactif. Les cellules souches de réserve indifférenciées se colorent en vert. Crédit :Jim Schwob/Université Tufts à Rapports sur les cellules souches
Une équipe de chercheurs de la Tufts University School of Medicine a développé une méthode pour cultiver et maintenir des cellules souches olfactives en culture, qui peut ensuite être utilisé pour restaurer les tissus du nez. La découverte laisse espérer que de futures thérapies pourraient être développées pour restaurer le sens de l'odorat chez les individus où il a été endommagé par une blessure ou une dégénérescence.
Les cellules souches, appelées cellules basales horizontales (HBC), peut repeupler tous les types cellulaires de l'épithélium olfactif (OE), y compris les neurones sensoriels, lorsqu'il est transplanté dans un tissu lésé. Publié aujourd'hui dans la revue Rapports sur les cellules souches , le développement ouvre la voie à de nouvelles recherches sur les thérapies de transplantation de cellules souches, ou des approches pharmacologiques qui stimulent les cellules souches dans le nez pour régénérer les tissus.
Les nerfs qui confèrent l'odorat sont uniques par rapport au reste du système nerveux, en ce qu'ils peuvent déclencher une réponse régénérative robuste et presque complète après une blessure. Le tissu OE contient deux types de cellules souches :les cellules basales globuleuses (GBC) et les HBC. Les GBC ont été cultivées avec succès et semblent avoir un rôle principal dans le repeuplement des cellules qui ont été perdues lors du renouvellement de routine. HBC, cependant, restent en sommeil et ne sont pas activés jusqu'à ce qu'il y ait une blessure. Malheureusement, les études sur ces cellules ont été limitées par le fait qu'elles ne pouvaient pas être multipliées et maintenues en culture. Dans cette étude, les chercheurs ont déterminé les conditions optimales pour développer et maintenir des cellules souches HBC saines en culture, emprunt de méthodes et de facteurs utilisés pour maintenir les cellules souches respiratoires.
« Une fois que nous avons déterminé que nous pouvions cultiver des HBC en laboratoire, et qu'ils exprimaient les mêmes marqueurs moléculaires d'identification trouvés in vivo, nous avons cherché à confirmer s'ils fonctionneraient aussi bien que les HBC in vivo - peuvent-ils régénérer les tissus qui ont été blessés - et ils l'ont fait !", a déclaré James Schwob, MARYLAND., Doctorat., professeur de biologie moléculaire et chimique du développement à la Tufts University School of Medicine, et auteur correspondant pour l'étude.
Malgré une capacité naturelle de régénération, un dysfonctionnement de l'odorat est encore signalé chez 19,4% de la population (étude OLFACAT, 2003), avec 0,3 pour cent éprouvant une perte complète de l'odorat. Les causes vont du vieillissement, blessure, fumeur, et les maladies neurodégénératives à certains médicaments.
Schwob et son équipe ont découvert que les HBC cultivés en laboratoire étaient capables de combler les lésions olfactives, générer plusieurs types de cellules, y compris les cellules Sus, cellules basales et neurones sensoriels olfactifs.
"Les HBC en culture sont restés au repos, à peu près comme ils le font in vivo, mais nous avons pu les déclencher dans un état actif pour démarrer le processus de différenciation en diverses cellules épithéliales olfactives juste avant de les greffer dans le tissu lésé, " a déclaré Jesse Peterson, Doctorat., premier auteur de l'étude et actuellement stagiaire postdoctoral au Laboratoire de biologie moléculaire du MRC. Peterson a mené l'étude dans le cadre de sa thèse de doctorat à la Sackler School of Graduate Biomedical Sciences de Tufts, conseillé par Schwob.
Le déclencheur utilisé était l'acide rétinoïque, ce qui a pour effet d'abaisser les niveaux de la protéine P63 dans les cellules, conduisant à l'activation des cellules souches. P63 fonctionne comme un « interrupteur de commande principal » et est connu pour diminuer les niveaux pendant les blessures, la transition des HBC de la dormance à l'activation in vivo. Une compréhension plus approfondie du rôle de P63 a été entravée par la lenteur des études in vivo. Avec des HBC cultivés en laboratoire, les mécanismes d'activation peuvent être examinés de plus près.
"Maintenant que nous pouvons créer une réserve de cellules souches dormantes, nous voyons cela comme un outil utile pour explorer des moyens de guider la différenciation cellulaire vers des types de cellules spécifiques, et développer de nouvelles thérapies à base de cellules souches pour la régénération tissulaire et sensorielle, en utilisant les propres cellules souches du patient pour la culture et la transplantation, ou des interventions pharmacologiques pour activer les propres cellules souches dormantes du patient dans le nez, " dit Schwob.