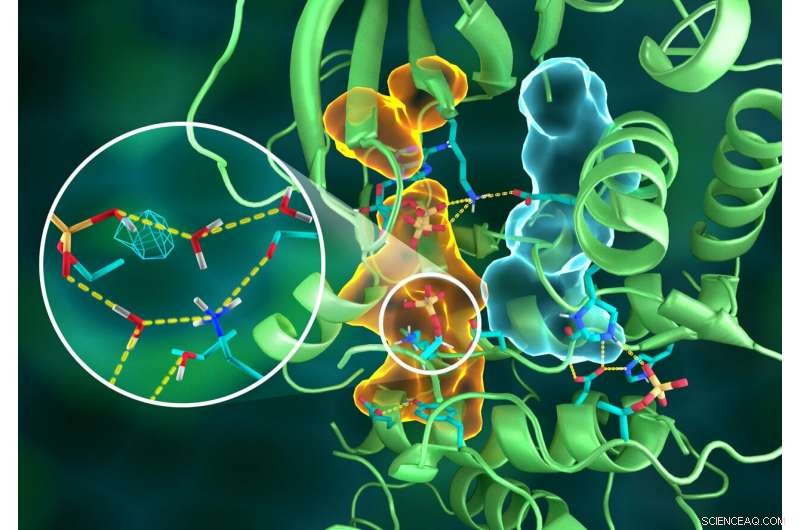
Illustration de l'organisation complexe de la structure PKA, dans lequel différentes parties de la protéine sont connectées par des réseaux élaborés de liaisons hydrogène (lignes jaunes en pointillés), collés ensemble par les assemblages hydrophobes (volumes bleu clair et orange) -- tous travaillant ensemble pour construire le site actif fonctionnel. L'insert montre la protonation du groupe phosphoryle transféré (maille cyan) et ses nombreuses interactions avec l'eau et les résidus d'acides aminés du site actif. Crédit :ORNL/Jill Hemman
Les observations directes de la structure et du mécanisme catalytique d'une enzyme kinase prototype - la protéine kinase A ou PKA - fourniront aux chercheurs et aux développeurs de médicaments des capacités considérablement améliorées pour comprendre et traiter les maladies mortelles et les troubles neurologiques tels que le cancer, Diabète, et la mucoviscidose.
La découverte a été faite par une équipe internationale de chercheurs utilisant la cristallographie neutronique macromoléculaire au Laboratoire national d'Oak Ridge du Département de l'énergie et à l'Institut Laue-Langevin de Grenoble, La France. S'appuyant sur une enquête de dix ans, les efforts combinés ont révélé des caractéristiques jusqu'alors inconnues de l'archétype de la protéine kinase, y compris une carte complète de la structure atomique et les fondements de la chimie de l'enzyme utilisée dans la signalisation cellulaire. Les détails sont publiés dans le journal Avancées scientifiques .
Les kinases sont un grand groupe de centaines d'enzymes responsables de l'initiation et de la régulation d'une myriade de processus cellulaires. Les kinases envoient des signaux aux protéines par phosphorylation, en ajoutant un groupe chimique réactif composé de phosphore et d'oxygène à un emplacement spécifique sur une protéine substrat pour activer sa fonction biologique spécifique.
Des problèmes surviennent lorsque des mutations génétiques provoquent un dysfonctionnement des kinases, qui à son tour conduit à la maladie. Une kinase défaillante, ou qui ne peut pas être désactivé, pourrait être responsable de la surexpression de protéines qui conduisent à la propagation incontrôlable des cellules cancéreuses. L'inverse est également vrai dans les troubles neurologiques dans lesquels une kinase défectueuse provoque simplement la mort des cellules.
« Créer des médicaments qui ciblent des kinases spécifiques est extrêmement important, " a déclaré le co-auteur Andrey Kovalevsky. " Cette compréhension détaillée de la structure de la PKA et de sa dynamique nous en dira plus sur les autres types de kinases et devrait aider les développeurs de médicaments à concevoir de nouveaux médicaments avec une meilleure spécificité, ce qui se traduirait en fin de compte par des thérapies plus précises avec moins d'effets secondaires."
Les changements dans la structure des protéines dus aux mutations peuvent être difficiles à détecter même si les effets des mutations sur le comportement dynamique des protéines peuvent être assez profonds. Cependant, ces comportements dynamiques deviennent plus apparents en examinant le réseau global de liaisons hydrogène à travers la protéine.
Les neutrons sont particulièrement sensibles aux éléments légers tels que l'hydrogène. Parce qu'environ 50 pour cent de tous les atomes dans les protéines sont de l'hydrogène, et la plupart des réactions chimiques catalysées par les enzymes impliquent l'hydrogène, Les neutrons sont une sonde idéale et inégalée pour détecter les positions des atomes d'hydrogène dans la structure de la protéine et suivre leur mouvement pendant la catalyse.
Diffraction des neutrons à l'aide du diffractomètre IMAGINE du réacteur isotopique à haut flux de l'ORNL, une installation utilisateur du DOE Office of Science, et le diffractomètre LADI-III de l'ILL a permis aux chercheurs de voir les positions exactes des atomes d'hydrogène pour révéler la structure complète de la kinase ainsi que les états de protonation de tous les acides aminés de la PKA et les ligands liés à son site actif, dont beaucoup étaient auparavant inconnus.
"Les neutrons nous ont permis de valider les prédictions par rayons X des positions des atomes d'hydrogène, ainsi que la détermination des états de protonation de groupes chimiques qui n'étaient pas connus, ou dans des endroits où nous ne nous attendions pas à les trouver. Cette avancée chimique majeure ouvre la voie à des études de modélisation et de simulation moléculaires plus sophistiquées de la structure et de la fonction des protéines kinases, " a déclaré l'auteur correspondante Susan Taylor.
"Les neutrons offrent une vue sans précédent du réseau de liaisons hydrogène entourant et au sein du site actif de la PKA et donnent des informations cruciales sur la façon dont la transmission allostérique de l'information à travers la structure de la protéine se produit, " a ajouté le co-auteur Gianluigi Veglia. " La combinaison de la cristallographie neutronique et de la spectroscopie de résonance magnétique nucléaire fournira une compréhension globale du fonctionnement des enzymes. "