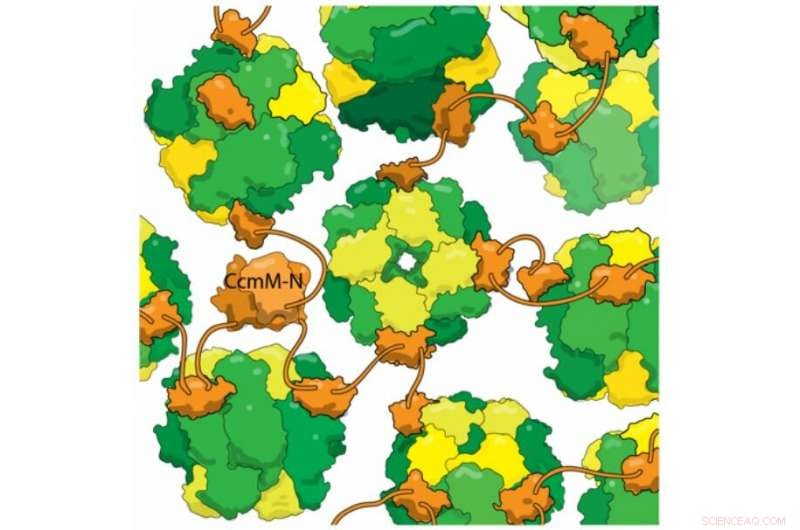
De nouvelles preuves structurelles montrent que la protéine cyanobactérienne CcmM (orange) se lie aux enzymes RuBisCo entièrement assemblées (jaune et vert) sans déloger les sous-unités RbcS (jaune). Ce mélange réticulé forme la base du carboxysome, un compartiment utilisé par les bactéries pour éviter la photorespiration. La photorespiration est une étape inutile de la photosynthèse causée lorsque RuBisCo fixe l'oxygène au lieu du dioxyde de carbone, et on pense qu'il réduit le rendement de certaines cultures de plus de 20 %. En piégeant le dioxyde de carbone dans les carboxysomes, les bactéries augmentent sa concentration, aider RuBisCo à corriger correctement le CO2. Une meilleure compréhension de l'assemblage des carboxysomes pourrait aider à concevoir des cultures à plus haut rendement dans un avenir proche.
Cette recherche apparaît dans le Journal de chimie biologique . Crédit :Ryan et al ., Journal de chimie biologique , 2019. (DOI :10.1074/jbc.RA118.006330)
Les chercheurs confrontés à un avenir avec une population plus importante et un climat plus incertain cherchent des moyens d'améliorer les rendements des cultures, et ils recherchent des bactéries photosynthétiques pour des solutions d'ingénierie.
Dans le Journal de chimie biologique , une équipe de recherche canadienne explique comment les cyanobactéries affinent l'une des étapes les plus inutiles de la photosynthèse. L'étude a examiné l'assemblage de carboxysomes dans lesquels les bactéries concentrent le dioxyde de carbone, augmenter l'efficacité d'une enzyme critique appelée RubisCO.
"Essentiellement, tout ce que nous mangeons commence par RubisCO, " a déclaré Matthew Kimber, professeur à l'Université de Guelph en Ontario, Canada, et auteur principal de l'article récent.
L'enzyme, qui est composé de 16 sous-unités protéiques, est indispensable à la photosynthèse. En utilisant l'énergie captée par la lumière, il incorpore du dioxyde de carbone dans des molécules organiques à partir desquelles la plante fabrique alors un nouveau sucre. Malheureusement, ce n'est pas terriblement efficace. Ou, du point de vue de Kimber, "RubisCO a une tâche vraiment ingrate."
L'enzyme a évolué dans un monde ancien où le dioxyde de carbone était courant et l'oxygène rare. Par conséquent, il n'est pas très pointilleux dans la discrimination entre les deux gaz. Maintenant que les tables atmosphériques ont tourné, RubisCO capte souvent accidentellement de l'oxygène, générant un composé inutile que l'usine doit alors investir de l'énergie supplémentaire pour recycler.
Par rapport aux plantes, les cyanobactéries commettent très peu de telles erreurs. En effet, les bactéries collectent leur RubisCO dans des corps denses appelés carboxysomes. Les bactéries pompent du bicarbonate (simplement du CO2 hydraté) dans la cellule; une fois qu'il pénètre dans le carboxysome, les enzymes transforment le bicarbonate en dioxyde de carbone. Parce que le dioxyde de carbone ne peut pas s'échapper à travers l'enveloppe protéique entourant le carboxysome, il s'accumule à des concentrations élevées, aider RubisCO à éviter des erreurs coûteuses.
L'intérêt de Kimber pour les carboxysomes réside principalement dans la compréhension de la logique de leur organisation. "Ce sont en fait des machines incroyablement complexes, " explique-t-il. " La cyanobactérie fabrique environ onze protéines d'apparence normale, et ceux-ci s'organisent d'une manière ou d'une autre en ce méga-complexe autorégulateur qui peut dépasser la taille d'une petite cellule."
L'une des astuces les plus impressionnantes des carboxysomes est l'auto-assemblage, que le laboratoire de Kimber a tenté de comprendre. Ils ont examiné une protéine appelée CcmM, qui enferme les enzymes RubisCO dans de nouveaux carboxysomes. Ils savaient qu'une partie de CcmM ressemble beaucoup à une sous-unité de RubisCO, à tel point que En réalité, que les chercheurs soupçonnent que d'anciennes cyanobactéries ont créé à l'origine CcmM en dupliquant un gène RubisCO. La plupart des scientifiques dans le domaine pensaient que CcmM se lie à l'enzyme en usurpant la tache de cette sous-unité. Mais lorsque le laboratoire de Kimber a examiné en détail CcmM, en utilisant des techniques biophysiques pour observer la structure et la liaison de la protéine, les résultats ont montré que la sagesse reçue était fausse. Vrai, CcmM était de forme similaire à la petite sous-unité RubisCO. Mais les complexes qu'il formait comprenaient toujours les 8 petites sous-unités, ce qui signifie qu'au lieu de voler une place à une sous-unité RubisCO, CcmM devait être contraignant ailleurs.
"C'est très étrange d'un point de vue biologique, car si CcmM est né en dupliquant la petite sous-unité, il est presque certainement lié à l'origine de la même manière, " Kimber a déclaré. "À un moment donné, il doit avoir évolué pour préférer un nouveau site de liaison."
Les chercheurs ont également découvert qu'un lieur entre les domaines de liaison dans CcmM est suffisamment court pour que "au lieu de s'enrouler autour de RubisCO, il attache (enzymes individuelles) ensemble comme des perles sur une ficelle. Avec plusieurs de ces linkers liant chaque RubisCO au hasard, il réticule tout dans ce gros globe ; tu l'entoures d'une coquille, et cela devient alors le carboxysome."
Des scientifiques d'une autre université ont rapporté l'automne dernier qu'ils avaient réussi à fabriquer des plants de tabac avec un carboxysome dépouillé dans leurs chloroplastes. Ces plantes n'ont pas particulièrement bien poussé, et les auteurs ont conclu qu'ils avaient enlevé trop de composants du carboxysome; bien qu'il puisse être construit dans le chloroplaste, c'était un frein pour les plantes au lieu d'une aide. Une meilleure compréhension de la façon dont des protéines telles que CcmM contribuent à la construction et à la fonction des carboxysomes pourrait aider les bio-ingénieurs à tirer parti de l'efficacité des carboxysomes dans la prochaine génération de plantes modifiées.