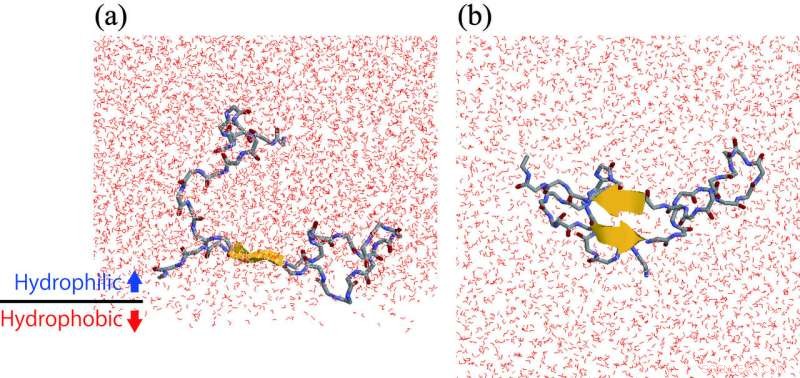
(a) Un peptide Aβ qui forme une structure en épingle à cheveux à l'interface hydrophile/hydrophobe. (b) Vue du bas du panneau (a). Crédit :ExCELLS/IMS
La maladie d'Alzheimer est causée par des agrégats de peptides amyloïdes-β (Aβ). Cette agrégation est accélérée à la surface de la membrane cellulaire. À l'aide de simulations de dynamique moléculaire et d'expériences RMN, le groupe de recherche d'ExCELLS a révélé la raison de ce phénomène. Les résultats ont été publiés dans le Journal de chimie physique B .
De nombreuses protéines s'agrègent à des concentrations plus élevées et forment des substances sphériques appelées oligomères et des substances aciculaires appelées fibrilles amyloïdes. Ces agrégats de protéines provoquent plus de 30 types de maladies. Par exemple, On pense que la maladie d'Alzheimer est causée par les oligomères et les fibrilles amyloïdes formés par l'agrégation de peptides amyloïdes-β (Aβ). Il est connu que l'agrégation du peptide Aβ est accélérée à une interface hydrophile/hydrophobe telle qu'une surface de membrane cellulaire. Cependant, pourquoi les peptides Aβ ont tendance à s'agréger à la surface n'a pas encore été bien compris.
Le groupe de recherche du Centre de recherche exploratoire sur la vie et les systèmes vivants et de l'Institut des sciences moléculaires, Japon, travaillé sur ce problème en utilisant des simulations de dynamique moléculaire et des expériences de spectroscopie de résonance magnétique nucléaire. Ils ont découvert que les peptides Aβ ont tendance à se rassembler à l'interface hydrophile/hydrophobe. C'est-à-dire, la concentration locale d'Aβ à l'interface est supérieure à celle de la solution aqueuse en vrac. En outre, Les structures en épingle à cheveux se forment davantage à l'interface que dans la solution aqueuse en masse. Dans la structure en épingle à cheveux , comme le montre la figure, une partie du peptide Aβ s'étend droit et forme des liaisons hydrogène intramoléculaires. Par conséquent, un autre peptide Aβ qui se rapproche de ce peptide établit facilement des liaisons hydrogène intermoléculaires et a tendance à s'agréger. De cette façon, le groupe de recherche a précisé que l'accélération de l'agrégation des peptides Aβ à la surface de la membrane cellulaire est due à une concentration élevée de peptides Aβ à la surface de la membrane cellulaire, et leur structure, par lequel ils se lient les uns aux autres.
Cette découverte élucide le mécanisme par lequel le peptide Aβ s'agrège à la surface membranaire des cellules nerveuses. Ce mécanisme pourrait être appliqué au développement d'inhibiteurs contre les substances responsables de la maladie d'Alzheimer à l'avenir.