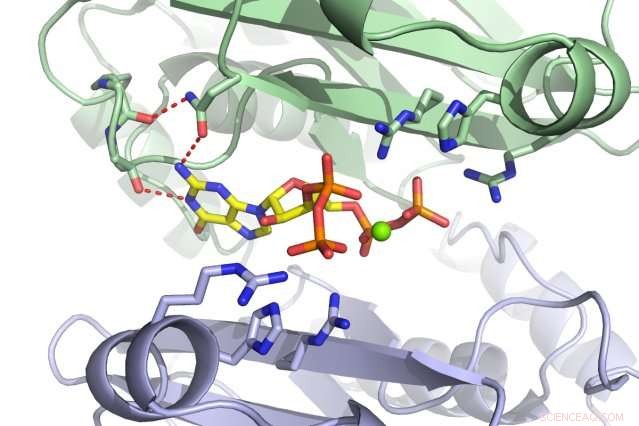
Une équipe du MIT a découvert que la petite molécule ppGpp (rouge) se lie à l'enzyme PurF (sous-unités représentées en vert et violet). Crédit :Massachusetts Institute of Technology
En 1969, Le scientifique Michael Cashel analysait les composés produits par des bactéries affamées lorsqu'il a remarqué que deux taches apparaissaient sur son chromatogramme comme par magie. Aujourd'hui, nous connaissons l'un de ces "points magiques, " comme les appellent les chercheurs, comme la guanosine tétraphosphate, ou ppGpp pour faire court. Nous comprenons également qu'il s'agit d'une molécule de signalisation présente dans pratiquement toutes les bactéries, aider à régler la croissance et la taille des cellules en fonction de la disponibilité des nutriments.
Et encore, malgré des décennies d'études, la manière précise dont le ppGpp régule la croissance bactérienne est restée plutôt mystérieuse. L'exploration nécessite en outre une liste plus complète des molécules auxquelles le ppGpp se lie pour exercer ses effets.
Maintenant, des collaborateurs des départements de biologie et de chimie du MIT ont développé une méthode pour y parvenir, et ont utilisé leur nouvelle approche pour localiser plus de 50 cibles ppGpp dans Escherichia coli, dont environ la moitié n'avaient pas été identifiées auparavant. Beaucoup de ces cibles sont des enzymes nécessaires à la production de nucléotides, les éléments constitutifs de l'ADN et de l'ARN. Pendant les périodes où les bactéries n'ont pas assez de nutriments pour se développer et se diviser normalement, les chercheurs proposent que ppGpp empêche ces enzymes de créer de nouveaux nucléotides à partir de zéro, aider les cellules à entrer dans un état dormant.
"Avec de petites molécules ou métabolites comme le ppGpp, historiquement, il a été difficile de déterminer à quelles protéines ils se lient, " dit Michael Laub, professeur de biologie, un chercheur du Howard Hughes Medical Institute, et l'auteur principal de l'étude. "C'est un problème insoluble qui a retenu le terrain pendant un certain temps, mais notre nouvelle approche vous permet de déterminer les cibles probables en quelques semaines."
Postdoc Boyuan Wang est le premier auteur de l'étude, qui apparaît dans Nature Chimie Biologie le 17 décembre.
L'endroit magique
Depuis que ppGpp a été découvert il y a près de 50 ans, il a été démontré qu'il supprime la réplication de l'ADN, transcription, Traduction, et diverses voies métaboliques. Il freine la croissance cellulaire et permet aux bactéries de persister face à la famine, stress, et des antibiotiques. Son influence sur de nombreux processus réglementaires est restée un peu mystérieuse, cependant, après tout, il ne se contente pas de moduler une seule voie mais coordonne plusieurs opérations simultanément pour orchestrer un arrêt de masse de la cellule.
Afin de discerner quelles protéines ppGpp se lie pour effectuer un tel changement généralisé, les chercheurs ont construit ce qu'ils appellent des "composés de capture" qui contiennent du ppGpp, leur permettant de repêcher ses cibles à partir d'extraits bactériens. Ces composés comprenaient un agent de réticulation photoréactif qui s'accrochait étroitement aux protéines d'intérêt en présence de lumière, et une poignée en biotine qui a aidé les scientifiques à extraire les protéines pour les identifier. Plus important encore, ils ont été joints à ppGpp de telle manière qu'ils n'interfèrent pas avec sa capacité à se lier à ses cibles. Cette méthode est plus efficace et précise par rapport aux moyens plus traditionnels de distinction des cibles ppGpp, qui sont beaucoup plus ardues et manquent de sensibilité.
« Notre approche résout ces problèmes car vous n'êtes plus obligé d'effectuer de tels protocoles à forte intensité de main-d'œuvre pour identifier les cibles ppGpp - et cela fonctionne même dans les bactéries au-delà d'E. coli, " dit Wang. " Bien que ppGpp soit commun parmi de nombreuses espèces bactériennes, il semble exercer ses effets par différents mécanismes, ce qui complique les choses. Nos composés de capture offrent un moyen de démêler cette diversité, et en peu de temps."
Freiner la production de nucléotides
Bien que les 56 cibles ppGpp que Wang ait identifié dans son écran contrôlent une myriade de processus cellulaires, il s'est penché sur l'enzyme PurF, qui initie la biosynthèse de nucléotides puriques portant des bases adénine et guanine, également connu sous les noms A et G.
Lorsque les bactéries sont stressées ou affamées, ils entrent dans un état dormant pour survivre. Mais il ne suffit pas de limiter la traduction et la transcription; des nucléotides sont encore générés et s'accumuleront si leur synthèse n'est pas mise en pause. Les cellules peuvent construire des nucléotides de deux manières :soit en récupérant des matériaux existants, soit en repartant de zéro. PurF lance la première étape de ce dernier processus menant aux nucléotides A et G. Cependant, lorsque ppGpp se lie à PurF, il fait changer la forme de l'enzyme, qui l'empêche de faire son travail, réduisant ainsi la production de nucléotides dans la cellule.
"C'est la première fois qu'une enzyme impliquée dans cette voie ou fonction spécifique est identifiée comme cible ppGpp, " dit Wang. " Si vous limitez la consommation de nucléotides mais pas leur production, le pool de nucléotides va exploser, ce qui n'est pas bon pour la cellule. Nous avons donc montré que ppGpp résout également ce problème."
En plus de PurF et d'autres enzymes nécessaires à la production de nucléotides, les chercheurs ont remarqué que ppGpp se lie également à de nombreuses enzymes GTPases impliquées dans la traduction. Cela pourrait indiquer un mécanisme à sécurité intégrée ralentissant la traduction en frappant plusieurs, enzymes similaires d'une manière presque redondante face à la famine.
Alors que Wang continue d'affiner sa méthode, il vise à augmenter sa spécificité et à garantir que ses composés de capture se lient exactement aux mêmes protéines qu'ils le feraient à l'intérieur d'une cellule vivante. Il espère également dépister les protéines de liaison ppGpp dans d'autres bactéries, y compris les agents pathogènes qui dépendent de ppGpp pour survivre au sein de leurs hôtes et propager des conditions telles que la tuberculose.
"Il s'agit d'une approche chimique passionnante pour mieux comprendre la fonction d'une molécule de signalisation conservée de longue date chez les bactéries, " dit Jue Wang, professeur de bactériologie à l'Université du Wisconsin à Madison, qui n'a pas participé à l'étude. "Leurs découvertes et techniques sont très pertinentes pour de nombreuses autres bactéries, et améliorera considérablement les connaissances sur la façon dont les bactéries utilisent cette molécule de signalisation critique pour tout arbitrer, de la survie dans l'intestin humain à la cause de la maladie. »
Laub ajoute :« Nous découvrons encore aujourd'hui de nouvelles molécules de signalisation à base de nucléotides chez les bactéries, et chacun d'entre eux pourrait éventuellement être dérivé d'une manière similaire pour identifier leurs partenaires de liaison. »
Cette histoire est republiée avec l'aimable autorisation de MIT News (web.mit.edu/newsoffice/), un site populaire qui couvre l'actualité de la recherche du MIT, innovation et enseignement.