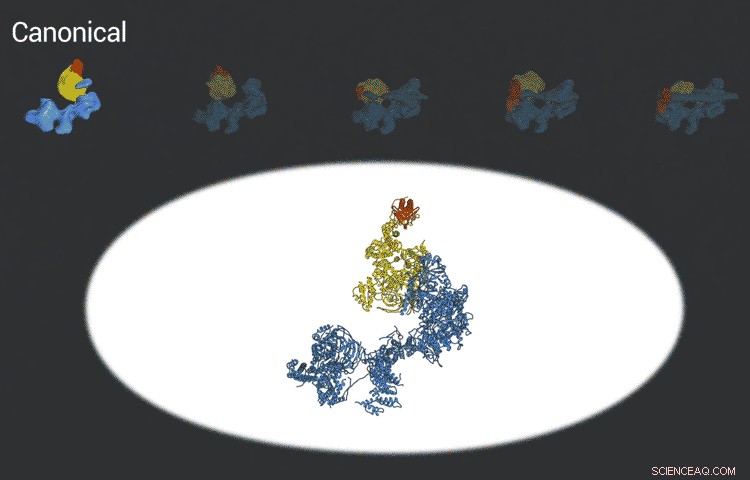
Le complexe du facteur de transcription IID se verrouille sur l'ADN, vérifie qu'il est au bon endroit, puis recrute d'autres protéines pour commencer à transcrire l'ADN en ARN. De nouvelles avancées en cryo-EM ont permis aux chercheurs de définir cinq conformations distinctes de TFIID pendant qu'il se verrouille et se charge. Crédit :laboratoire Eva Nogales
Repousser les limites de la cryo-microscopie électronique, Université de Californie, Berkeley, les scientifiques ont capturé des images fixes de la forme changeante d'une énorme molécule, l'une des machines moléculaires clés du corps, car il se verrouille sur l'ADN et charge la machinerie pour lire le code génétique.
La molécule, appelé facteur de transcription IID, est essentiel pour transcrire les gènes en ARN qui seront ensuite utilisés comme modèles pour fabriquer des protéines. En raison de ses nombreuses pièces mobiles et de sa grande taille, cependant, La structure 3D de TFIID a été difficile à capturer :les parties en mouvement deviennent floues.
Cryo-EM, une technique d'imagerie dont les découvreurs ont remporté le prix Nobel de chimie 2017, est le seul moyen d'obtenir un instantané des encombrants, structures de disquette comme celle-ci. Les informations structurelles à haute résolution sont essentielles pour comprendre comment TFIID traduit les instructions opératoires dans notre génome et comment cela se détraque parfois.
Le nouveau, des instantanés plus détaillés des pièces mobiles de la molécule pourraient aider les concepteurs de médicaments à créer des médicaments qui interfèrent avec les changements structurels de la molécule afin de modifier l'expression d'un gène qui cause la maladie.
"Ces structures vous offrent la possibilité de concevoir rationnellement de petites molécules qui perturberont le fonctionnement normal, car maintenant nous n'avons plus qu'une seule structure, nous avons de nombreuses structures, ce qui est encore plus puissant parce que nous pouvons cibler le mouvement que nous voyons en ce moment, " a déclaré Eva Nogales, professeur de biologie moléculaire et cellulaire à l'UC Berkeley et chercheur universitaire au Lawrence Berkeley National Laboratory.
Nogales et ses collègues, principalement les étudiants diplômés de l'UC Berkeley Avinash Patel et Robert Louder, ont publié leurs conclusions en ligne cette semaine avant la publication imprimée dans le journal Science .
"L'endroit où vous placez ce médicament et la façon dont vous le faites fonctionner dépendent fortement de la nature transitoire de ces structures, et c'est quelque chose que nous n'avons réalisé que très récemment, " a déclaré Robert Tjian, un professeur de biologie moléculaire et cellulaire à l'UC Berkeley qui a découvert le TFIID et a travaillé sur la molécule pendant une grande partie de sa carrière, même s'il n'était pas co-auteur du nouveau document. "Parce que ces molécules se déplacent et que leurs structures sont si compliquées, la découverte de médicaments conventionnels ne révélerait jamais ce qui se passe. Les structures d'Eva vont changer cela. Cela a le potentiel d'ouvrir l'univers des cibles médicamenteuses."
Congeler des molécules
TFIID est une agglomération de plus d'une douzaine de protéines distinctes qui se concentrent sur un promoteur - une région d'ADN qui contrôle la transcription d'un gène voisin - et teste la séquence pour s'assurer qu'elle a atterri au bon endroit. Une fois cela confirmé, il s'ouvre pour recruter des dizaines d'autres protéines qui commencent alors à se déplacer le long du gène, utiliser la séquence d'ADN comme matrice pour créer une séquence complémentaire d'ARN, appelé ARN messager. Cela se fraie ensuite un chemin hors du noyau dans le corps de la cellule, où il est traduit par d'autres machines moléculaires en protéine.
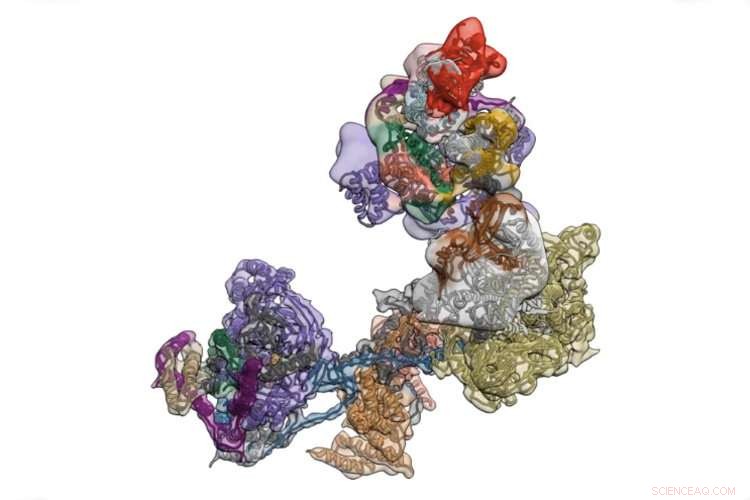
Le TFIID est un complexe de protéines qui initie la transcription des instructions de fonctionnement du corps codées dans l'ADN. Crédit :Université de Californie - Berkeley
"TFIID est probablement la structure la plus difficile que quiconque ait essayé de résoudre, car il est massif et il est très flexible, " a déclaré Tjian. " La seule façon de voir ces structures très flexibles est par cryo-EM, et Eva peut maintenant figer tous ces différents états flexibles et décrire le mouvement."
La cryo-EM consiste à congeler une goutte contenant des millions de copies d'une molécule, dans toutes les orientations imaginables, et en utilisant un microscope électronique pour déterminer la structure en combinant des images pour définir la forme 3-D. Parce que TFIID a de nombreuses pièces mobiles car il se lie à l'ADN et se prépare à transcrire un gène, la moyenne de toutes les positions gelées produit une image floue.
Nogales compare les efforts précédents d'imagerie TFIID, y compris ses propres tentatives remontant à près de 20 ans, à prendre une photo d'une équipe de football sur le terrain et à faire la moyenne des mouvements de tous les joueurs. Le résultat est un torse humain générique avec une tête et des membres flous.
Imaginer le terrain de football
Maintenant, grâce à plus de deux ans de travail intensif de Patel et Louder, il est possible de capturer des images à plus haute résolution qui s'apparentent à distinguer le coup de pied d'un attaquant du bloc de main d'un gardien de but et de la tête d'un arrière.
"Imaginez que vous ayez une image des 22 footballeurs sur le terrain, et vous deviez les combiner en une seule unité que vous appelleriez le « joueur de football générique », '", a-t-elle dit. "Cela ressemblera à une image floue - vous pouvez à peine voir qu'il s'agit d'une forme humanoïde et qu'il y a une sorte de mouvement, mais vous ne vous rendriez pas compte qu'il existe une différence entre les joueurs."
Les images améliorées sont le résultat de meilleurs détecteurs développés à l'origine par des collègues du Berkeley Lab, et l'amélioration constante des algorithmes informatiques pour analyser les énormes quantités de données collectées par les détecteurs. Cela a aidé Nogales et son équipe à définir cinq structures distinctes de la molécule TFIID.
"They span the whole binding sequence:before binding to the DNA, initial binding to the promoter, subsequent binding after it double checks that this is the right place, and the final state, " Nogales said.
She and her colleagues continue to push the limits of cryo-EM, hoping to determine the 3-D structure of TFIID after other transcription proteins land on it to complete the transcription process.