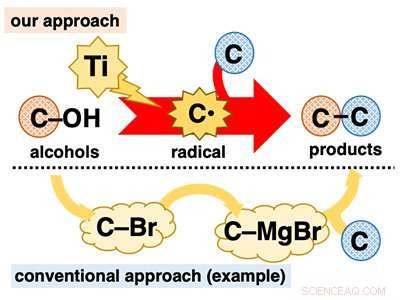
Utilisation directe d'alcools pour les réactions de formation de liaisons C-C. Crédit :Université de Kanazawa
Les alcools jouent un rôle central dans la synthèse organique car ils sont omniprésents et peuvent être utilisés dans une variété de transformations bien établies. Cependant, dans les réactions de formation de liaisons C-C, bien qu'étant au cœur de la synthèse organique, les alcools sont pour la plupart employés de manière indirecte. De nombreuses réactions à base d'alcool nécessitent une pré-transformation fastidieuse du groupe hydroxy (C-OH) en d'autres groupes fonctionnels tels que les halogènes (par exemple, C-Br) avant la formation de liaisons C-C (Figure 1).
Le développement de réactions de formation de liaisons C-C en une étape utilisant des alcools est hautement souhaitable car il permet l'application de matériaux omniprésents sans la charge d'une procédure en plusieurs étapes. Une façon d'atteindre cet objectif est de convertir directement les alcools en intermédiaires réactifs connus qui subissent instantanément des réactions de formation de liaisons C-C. Nous avons imaginé pouvoir y parvenir en utilisant des réactifs au titane de faible valence. Le titane de faible valence est un réducteur à un électron et une espèce hautement oxophile. En raison de ces caractéristiques, on s'attend à ce que le titane de faible valence puisse extraire un atome d'oxygène de l'alcool, le clivage de la liaison C-O dans une réduction à un électron pour générer le radical carboné correspondant (C* ). Le radical carbone est un intermédiaire extrêmement réactif qui subit facilement diverses réactions, y compris la formation de liaisons C-C.
Résultats
Le traitement du 2-naphtalèneméthanol avec un réactif au titane de faible valence a donné un mélange de deux produits de clivage C-O provenant de l'hydrogénation et de la dimérisation (figure 2). Ces réactions elles-mêmes n'étaient pas très utiles; cependant, ils étaient tous deux la preuve de la génération d'espèces radicalaires benzyles. Avec ce résultat préliminaire, nous nous attendions à ce que l'ajout d'agents de piégeage des radicaux donnerait les produits de couplage entre le radical benzyle et les agents de piégeage, interrompre les réactions d'hydrogénation et de dimérisation. En effet, l'ajout d'acrylonitrile comme agent de piégeage a donné le produit de couplage entre le radical benzyle et l'acrylonitrile comme produit prédominant.
Le meilleur résultat a été obtenu lorsque le réactif de titane de faible valence a été préparé à partir de TiCl4 (collidine) et de poudre de manganèse. Cette réaction de formation de liaison directe C-C à base d'alcool a été appliquée avec succès à une série de dérivés d'alcool benzylique. Remarquablement, les deux alcools benzyliques avec des substituants électrodonneurs et électro-attracteurs sur le cycle aromatique convenaient pour cette réaction. Par ailleurs, en plus des alcools primaires, les alcools secondaires et tertiaires convenaient également malgré l'augmentation considérable de l'encombrement stérique. Plusieurs alcènes déficients en électrons autres que l'acrylonitrile étaient également de bons réactifs. En ce qui concerne la praticité, cette réaction est économique et facile à réaliser, au moins à l'échelle du laboratoire. TiCl
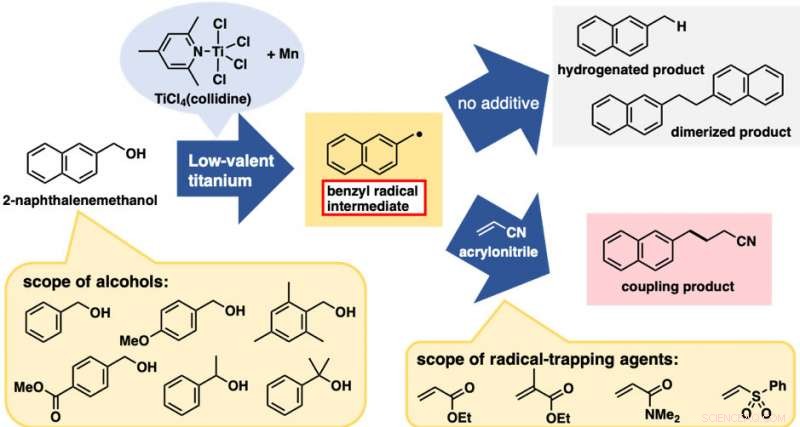
Réactions de formation de liaisons C-C directes à base d'alcool. Flèche supérieure :réactions sans agent de piégeage. Flèche du bas :réactions avec des agents piégeurs de radicaux (alcènes déficients en électrons). Crédit :Université de Kanazawa
Importance et perspectives d'avenir
L'intérêt de cette méthode est qu'elle permet l'utilisation directe d'alcools comme équivalents radicaux de carbone. Nous avons établi un lien entre les alcools omniprésents et les connaissances accumulées sur les réactions radicalaires. Nous pensons que ce travail suscitera des recherches sur d'autres réactions radicalaires à base d'alcool dans un proche avenir.