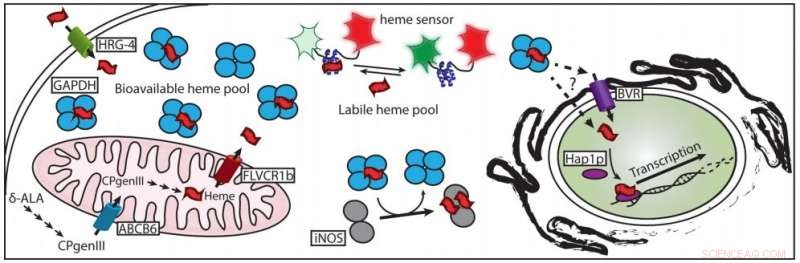
Un article récent décrit comment l'hème est chaperonné à ses protéines cibles. Crédit :Dennis Stuehr, Clinique de Cleveland
Vous aimez respirer de l'air ? Vous devriez penser de temps en temps à l'hème, une molécule contenant du fer essentielle à tous les organismes engagés dans un mode de vie respirant l'air. Les molécules d'hème font partie de l'hémoglobine, la protéine de transport d'oxygène dans le sang, mais ils sont également des composants de nombreuses autres protéines impliquées dans le transport des gaz et la chimie fondamentale dans les cellules. A lui seul, l'hème est toxique et réactif, mais lorsqu'il est correctement inséré dans certaines protéines, c'est absolument indispensable.
Jusque récemment, un mystère fondamental à propos de l'hème n'est pas résolu :comment cela provient-il des mitochondries, où il est fabriqué, aux protéines dans d'autres parties de la cellule où cela est nécessaire ?
Une équipe de chercheurs du Lerner Research Institute de la Cleveland Clinic a maintenant résolu cette énigme de longue date en identifiant la protéine qui « chaperonne » l'hème libre dans les cellules en s'y liant, l'empêchant d'endommager la cellule jusqu'à ce qu'elle soit livrée là où elle est nécessaire. Les résultats sont publiés dans le Journal de chimie biologique .
Dennis Stuehr, l'investigateur de la Cleveland Clinic qui a supervisé la nouvelle étude, s'intéressait depuis des années au mystère du chaperon hème inconnu. "C'était surprenant que vraiment presque rien n'était connu, " Stuehr a dit. " Dans la littérature, on dirait que tout le monde vient d'éteindre les lumières et rentre chez lui."
Petit à petit, L'équipe de Stuehr a reconstitué la biochimie de l'hème libre. La première étape consistait à découvrir simplement à quelles protéines l'hème peut se lier. Puis, ils devaient expérimenter pour voir laquelle des protéines que l'hème adhère pour l'aider à atteindre sa destination finale.
"Heme est un peu collant; il se lie à beaucoup de choses, " a déclaré Elizabeth Sweeny, le boursier postdoctoral qui était l'un des co-responsables de la nouvelle étude. "Cette (étude) était la première fois que nous trouvions une protéine qui non seulement se lie à l'hème, et en lie beaucoup, mais est également nécessaire pour la livraison aux cibles de protéines hémiques en aval."
La nouvelle étude utilise plusieurs éléments de preuve pour impliquer un acteur inattendu en tant que chaperon de l'hème :la glycéraldéhyde 3-phosphate déshydrogénase, ou GAPDH. La GAPDH est une enzyme impliquée dans la dégradation du sucre dans les cellules. C'est un lieu commun, composant peu glorieux du métabolisme de base de la cellule, à tel point que les scientifiques de laboratoire l'utilisent principalement comme contrôle de base dans les études d'autres protéines.
« GAPDH est un candidat tellement ridicule, " Stuehr a déclaré. "Mais il y a eu cette histoire émergente que GAPDH n'est pas seulement cette enzyme glycolytique ennuyeuse qui est dans chaque cellule; il a ces autres rôles en biologie cellulaire. Et la livraison de l'hème est l'un de ces nouveaux rôles."
La GAPDH n'est peut-être pas la seule protéine impliquée dans le chaperonnage de l'hème, Stuehr ajoute, et la recherche sur plus de détails sur la façon dont l'hème est administré est en cours.
"Notre découverte répond à une question de biologie cellulaire qui existe depuis un certain temps, concernant le mécanisme de délivrance de cette biomolécule essentielle, " Stuehr a déclaré. " Maintenant, nous pouvons réfléchir et explorer comment la perturbation de ce processus de livraison pourrait réellement contribuer à un certain nombre de maladies, (comme) les anémies, l'asthme et plus encore."