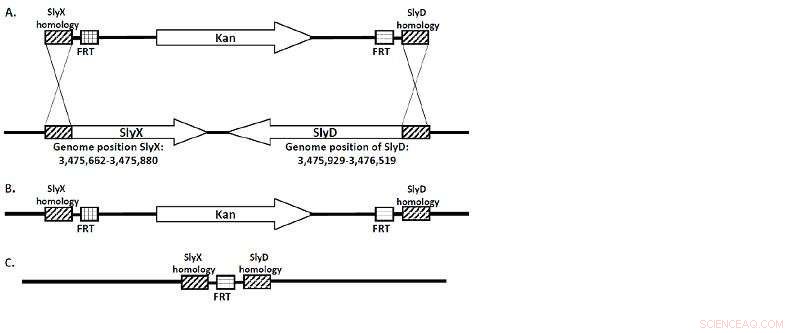
(A) La cassette KanR flanquée de régions homologues SlyX et SlyD. (B) La séquence entière de ces gènes est remplacée par la cassette KanR lors de la recombinaison. (C) La "cicatrice FRT" est tout ce qui reste une fois que la souche est "guéri" par flp-recombinase. Crédit :Université Lobatchevsky
Les systèmes bactériens sont parmi les plateformes les plus simples et les plus efficaces pour l'expression de protéines recombinantes. Ils sont plus rentables par rapport à d'autres méthodes, et sont donc d'un grand intérêt non seulement pour les chercheurs de l'Université Lobatchevsky, mais aussi pour les fabricants de médicaments importants sur le plan thérapeutique.
Cependant, en plus des protéines recombinantes cibles, les cellules produisent également un grand nombre de protéines endogènes, y compris SlyD. C'est une petite protéine composée de trois domaines. Sa région C-terminale est riche en résidus histidine, et SlyD présente donc une affinité élevée pour les ions 2-valents et est purifié avec les protéines cibles au cours d'une chromatographie d'affinité métallique. Il en résulte la nécessité d'étapes de purification supplémentaires, et en conséquence, augmente le coût du procédé technologique d'obtention de protéines recombinantes thérapeutiques.
Une équipe de chercheurs de l'Université Lobatchevsky dirigée par le professeur Viktor Novikov, Directeur du Centre UNN de biologie moléculaire et de biomédecine, a obtenu une série de souches d'E. coli déficientes en gènes SlyD/SlyX. Les souches ont été conçues en utilisant une délétion chromosomique médiée par le rouge . (Figure 1.)
"La séquence de SlyD/SlyX dans le génome d'E. coli a été remplacée par un gène responsable de la résistance à l'antibiotique kanamycine qui était flanqué des deux côtés par des sites FRT, d'où il a ensuite été éliminé par la recombinase FLP, ", note Viktor Novikov.
En utilisant l'exemple de la protéine recombinante bispécifique MYSTI-2 constituée de deux modules qui sont des centres actifs d'anticorps contre les protéines de souris F4/80 et TNF, les scientifiques ont comparé l'activité des protéines isolées des souches originales et mutantes. À la suite de l'étude, il a été déterminé que l'élimination du génome d'E. coli des gènes SlyD et SlyX, qui codent vraisemblablement des chaperons qui soutiennent la structure spatiale des protéines d'Escherichia coli, n'entraîne pas de perturbation de l'activité fonctionnelle des protéines recombinantes.
En obtenant des souches originales d'E. coli, les chercheurs ont pu résoudre le problème de contamination des protéines recombinantes et assurer leur purification en une seule étape avec succès par chromatographie d'affinité métallique.
"L'ensemble obtenu de souches d'E. coli déficientes en slyD/slyX peut être utilisé pour produire sous une forme pure une large gamme de protéines procaryotes et eucaryotes, y compris les protéines thérapeutiques médicales. Cela facilite le développement et la production de nouvelles préparations biologiques médicinales et préventives, plus simple et moins cher, " conclut Viktor Novikov.