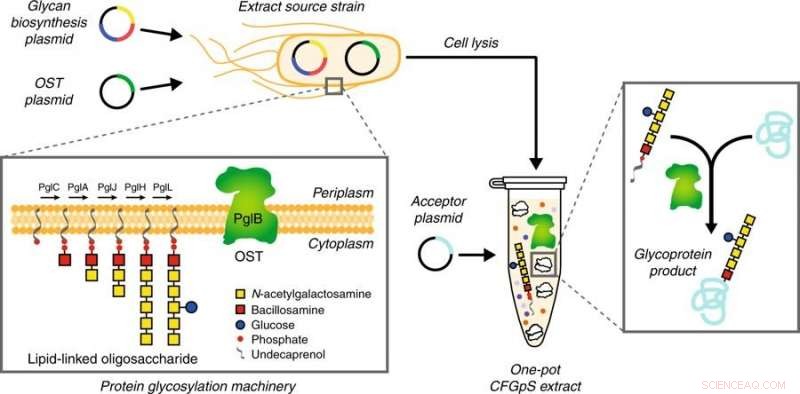
Schéma de la technologie CFGpS monopot. E. coli génétiquement modifiés avec (i) des mutations génomiques qui profitent aux réactions de glycosylation et (ii) un ADN plasmidique pour produire des composants essentiels de glycosylation (c'est-à-dire, OST, LLO) servent de souche source pour produire des extraits bruts de S30. Les composants de glycosylation candidats peuvent être dérivés de tous les règnes de la vie et comprennent des OST à sous-unité unique comme C. jejuni PglB et des LLO portant des N-glycanes de C. jejuni qui sont assemblés sur Und-PP par les enzymes de la voie Pgl. Après préparation de l'extrait par lyse de la souche source, la biosynthèse en un seul pot de N-glycoprotéines est initiée en amorçant l'extrait avec de l'ADN codant pour la protéine acceptrice d'intérêt. Crédit: Communication Nature (2018). DOI :10.1038/s41467-018-05110-x
Ingénierie biologie cellulaire, moins la cellule réelle, est un domaine d'intérêt croissant pour la biotechnologie et la biologie synthétique. C'est ce qu'on appelle la synthèse des protéines sans cellules, ou CFPS, et il a le potentiel de fournir des moyens durables de fabriquer des produits chimiques, médicaments et biomatériaux.
Malheureusement, une lacune de longue date dans les systèmes acellulaires est la capacité de fabriquer des protéines glycosylées, des protéines avec une fixation aux glucides. La glycosylation est cruciale pour un large éventail de processus biologiques importants, et la capacité de comprendre et de contrôler ce mécanisme est vitale pour le traitement et la prévention des maladies.
Matthieu DeLisa, le professeur d'ingénierie William L. Lewis à la Smith School of Chemical and Biomolecular Engineering de l'Université Cornell, et Michael Jewett, professeur agrégé de génie chimique et biologique à la Northwestern University, se sont associés à une nouvelle approche qui comble cette lacune. Leur système, le premier du genre, capitalise sur les avancées récentes du CFPS tout en ajoutant le composant crucial de glycosylation dans un format simplifié, réaction « à un seul pot ». La protéine de choix pourrait ensuite être lyophilisée et réactivée pour la synthèse au point d'utilisation en ajoutant simplement de l'eau.
DeLisa et Jewett sont co-auteurs principaux de « Biosynthèse de glycoprotéines en pot unique à l'aide d'un système de transcription-traduction sans cellule enrichi avec des machines de glycosylation, " publié le 12 juillet dans Communication Nature .
Thapakorn Jaroentomeechai, doctorat étudiant dans le groupe de recherche DeLisa, et Jessica Stark '12, doctorat étudiant dans le groupe Jewett, sont co-premiers auteurs.
"Si vous voulez vraiment avoir un utile, vaccins portables et déployables ou technologies de protéines thérapeutiques sans cellules, vous devez comprendre l'attachement aux glucides, " dit DeLisa. " C'est, en substance, ce que nous avons fait d'une manière très puissante."
Ce travail pourrait avoir un impact sur le développement de stratégies de fabrication décentralisées. L'accès rapide aux médicaments à base de protéines dans les régions éloignées pourrait changer des vies; de nouveaux paradigmes de bioproduction adaptés à une utilisation dans des environnements à faibles ressources pourraient favoriser un meilleur accès à des médicaments coûteux grâce à des production en petits lots.
DeLisa a effectué de nombreuses recherches sur les mécanismes moléculaires sous-jacents à la biogenèse des protéines dans l'environnement complexe d'une cellule vivante, tel que Escherichia coli ( E. coli ). Bien que son laboratoire ait fait des percées notables, les limites de ce domaine, il a dit, sont les parois cellulaires elles-mêmes.
Le laboratoire de Jewett à Northwestern a investi une grande partie de ses efforts de recherche dans la biologie synthétique sans cellules, qui exploite les biomachines les plus élégantes de la nature en dehors des limites de la cellule, une collaboration était donc un prolongement naturel du travail des deux laboratoires.
« En génie cellulaire bactérien, vous êtes constamment dans un bras de fer, " dit Jewett. " Vous introduisez un mécanisme ou une capacité qui vous intéresse en tant que scientifique, mais ce que la cellule essaie de faire pour elle-même, c'est de croître et de survivre."
Pour leur nouvelle méthode, l'équipe a préparé des extraits cellulaires à partir d'une souche de laboratoire optimisée d'E. coli, CLM24, qui ont été sélectivement enrichis avec des composants clés de la glycosylation. Les extraits obtenus ont permis un schéma réactionnel simplifié, que l'équipe a baptisée synthèse de glycoprotéines sans cellules (CFGpS).
"Une avancée majeure de ce travail est que nos extraits acellulaires contiennent toute la machinerie moléculaire pour la synthèse des protéines et la glycosylation des protéines, " dit Stark. "Ce que cela signifie, c'est qu'il vous suffit d'ajouter des instructions ADN pour votre protéine d'intérêt pour fabriquer une glycoprotéine dans CFGpS. Il s'agit d'une simplification drastique des méthodes basées sur les cellules et nous permet de fabriquer des molécules de glycoprotéines sophistiquées en moins d'une journée. »
Et la méthode CFGpS est hautement modulaire, permettant l'utilisation d'extraits distincts et divers à mélanger pour la production d'une variété de glycoprotéines.
"Parce que nous avons choisi E. coli, qui manque de sa propre machinerie de glycosylation, pour construire notre plateforme CFGpS, cela nous a donné une ardoise vierge pour l'ingénierie ascendante de tout système de glycosylation souhaité, " Jaroentomeechai a déclaré. "Cela nous donne la capacité unique de contrôler les structures glucidiques et les puretés des glycoprotéines à des niveaux qui ne sont actuellement pas réalisables dans d'autres systèmes d'expression à base de cellules."
Même dans les pays développés comme les États-Unis, l'évolution vers la médecine personnalisée rend attractif ce type de protocole de production de médicaments à la demande. "Vous pouvez utiliser un tube à essai au lieu d'un 50, Bioréacteur de 000 litres pour fabriquer votre produit, qui ouvre la porte à un paradigme de bioproduction personnalisé où chaque patient peut recevoir un médicament protéique unique adapté à sa physiologie, " il a dit.