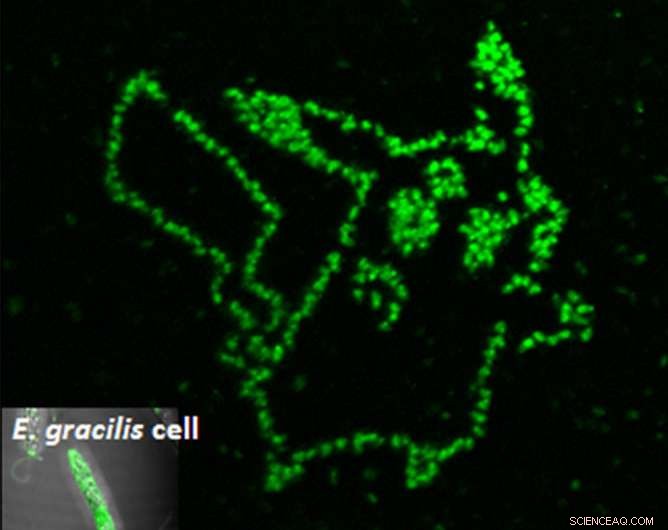
La photoporation d'un aptamère fluorogène dans des cellules de microalgues individuelles montre exactement où se trouve le métabolite souhaité. Crédit :Yoichiroh Hosokawa
A la recherche de nouvelles sources de consommables, les scientifiques ont fini par comprendre que la vie elle-même pourrait être la solution. Les ingénieurs métaboliques ont modifié le métabolisme des organismes vivants pour fabriquer de nouveaux médicaments, biodégradables et biocarburants. L'un des meilleurs exemples des temps modernes est la pénicilline. Les bactéries d'ingénierie métabolique ont amélioré le taux de production de ce médicament plus de 100 fois.
Un défi majeur dans ce domaine est d'identifier quelles cellules sont les plus productives. Il est relativement facile d'étudier des populations en vrac, ce qui donne des informations sur le métabolisme de la population cellulaire globale. Cependant, il reste extrêmement difficile d'identifier quelles cellules de la population globale se situent au-dessus des autres en termes de production de métabolites et sont donc les meilleures à copier et à imiter. Cette identification nécessite d'observer les processus internes des cellules individuelles en temps réel pendant que le métabolite est fabriqué. Des scientifiques de l'Institut des sciences et technologies de Nara (NAIST) signalent un nouveau système qui atteint cet objectif dans les cellules de microalgues. Le système combine des aptamères fluorogènes avec une photoporation laser femtoseconde. L'étude est publiée dans Rapports scientifiques .
"Les algues ont un certain nombre de qualités attrayantes pour l'ingénierie métabolique. Premièrement, ils sont extrêmement adaptatifs, car ils ont la capacité de vivre dans un large éventail d'environnements, de l'équateur aux pôles et même dans les eaux fortement salines ou polluées, " dit le professeur Yoichiroh Hosokawa, qui a dirigé l'étude.
Normalement, les scientifiques utilisent la microscopie à fluorescence pour regarder à l'intérieur d'une cellule. Cette stratégie consiste à attacher une molécule fluorescente au métabolite d'intérêt. Cependant, en raison de la protection de la paroi cellulaire, il a été difficile d'introduire des molécules fluorescentes qui détectent des métabolites spécifiques dans les cellules de microalgues de l'extérieur.
L'équipe de Hosokawa a donc développé des aptamères fluorescents qui émettent de la fluorescence lors de la liaison au métabolite paramylon et des méthodes de fabrication qui peuvent les introduire dans la cellule par des impulsions laser.
"Nous avons synthétisé un peptide aptamère se liant au paramylon, et l'a introduit dans les cellules d'Euglena gracilis par traitement laser à cellule unique, " a déclaré le Dr Takanori Maeno, qui est le premier auteur de l'étude. "Le paramylon est produit uniquement par Euglena et fonctionne comme la fibre. Il peut être raffiné en biocarburants, " il ajouta.
Pour faire entrer l'aptamère à l'intérieur de la cellule, les scientifiques ont tiré sur les cellules avec des impulsions laser de quelques femtosecondes seulement. Ces impulsions ont créé des pores temporaires suffisamment gros pour que les aptamères puissent entrer. Une fois à l'intérieur, les cellules ne virent au vert qu'aux endroits où les aptamères se lient au paramylon. En utilisant cette technique, Le groupe de Hosokawa a pu mesurer l'accumulation de paramylon avec le temps, discriminant ainsi les cellules efficaces de leurs voisines improductives.
Alors que le système n'a été testé que sur du paramylon, Hosokawa déclare que d'autres métabolites seront détectables avec des aptamères appropriés.
"Notre méthode donne des informations spatiales et temporelles sur le paramylon intracellulaire cible, mais devrait fonctionner pour tous les types de métabolites à l'avenir. Il sera utile pour sélectionner des cellules performantes, " il a dit.